艾伯维CD3/CD20双抗Epcoritamab在美获批滤泡性淋巴瘤适应症
2024年6月26日,艾伯维宣布FDA已批准Epcoritamab(商品名:Epkinly)用于治疗至少接受过两种系统治疗的复发或难治性滤泡性淋巴瘤(R/R FL)患者。
Epcoritamab(epcoritamab-bysp;Epkinly™;Tepkinly® )是一种全长免疫球蛋白 G1 (IgG1) 双特异性 T 细胞接合抗体,由 Genmab 和艾伯维共同开发,用于治疗成熟 B 细胞非霍奇金淋巴瘤淋巴瘤亚型(B-NHL) 。epcoritamab 源自人源化小鼠抗人 CD3 单克隆抗体和人抗 CD20 单克隆抗体,旨在同时结合 T 细胞上的 CD3 和 B 细胞上的 CD20,从而导致 T 细胞的激活和扩增以及 T 细胞介导的 CD20+ 恶性 B 细胞的杀伤。作为一种基于 IgG1 的双特异性抗体,epcoritamab 保留了与新生儿 Fc 受体的正常结合,从而导致相对较长的血浆半衰期。此外,这种结合不受引入旨在抑制 Fc γ 受体 (FcγR) 及其效应器功能的三点突变的影响。以这种方式修饰 Fc 区可确保 epcoritamab 不会通过抗体介导的、FcγR 依赖性 CD3 交联诱导 T 细胞活化,而只能通过 CD3 和 CD20 同时结合来诱导 T 细胞活化。Epcoritamab 于 2023 年 5 月 19 日在美国首次获得批准,用于治疗患有复发或难治性 (R/R) 弥漫性大 B 细胞淋巴瘤 (DLBCL) 的成年患者(非特指型)包括经过 ≥ 2 线全身治疗后惰性淋巴瘤引起的 DLBCL,和高级别 B 细胞淋巴瘤 (HGBCL) 。2024年2月28日,艾伯维(AbbVie)和Genmab联合宣布,美国FDA接受其CD20 x CD3靶向双特异性抗体Epcoritamab的补充生物制品许可申请(sBLA)并授予优先审评资格,用于治疗接受过两次与以上系统性疗法的复发或难治性(R/R)滤泡性淋巴瘤(FL)成人患者。该申请的PDUFA目标日期为2024年6月28日。
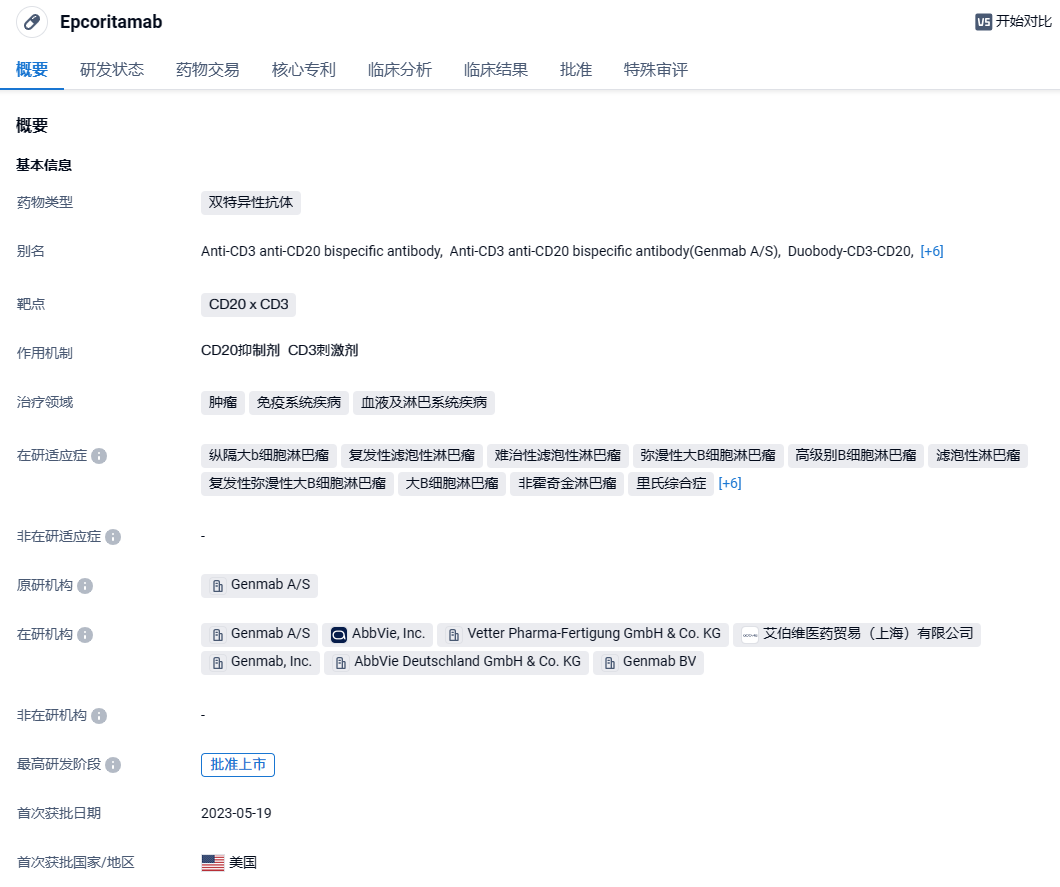
该sBLA的递交主要基于1/2期EPCORE NHL-1临床试验的结果,该试验证明使用epcoritamab治疗的R/R FL患者具有较高的总体和完全缓解率。这一开放标签临床试验总计有128名R/R FL患者入组,他们至少接受过两种以上的全身性治疗,70.3%的患者对抗CD20单抗和烷化剂产生双重耐药性。之前公布的顶线结果显示,根据独立审查委员会的评估,总缓解率达到82%,超过预先设定的疗效阈值。
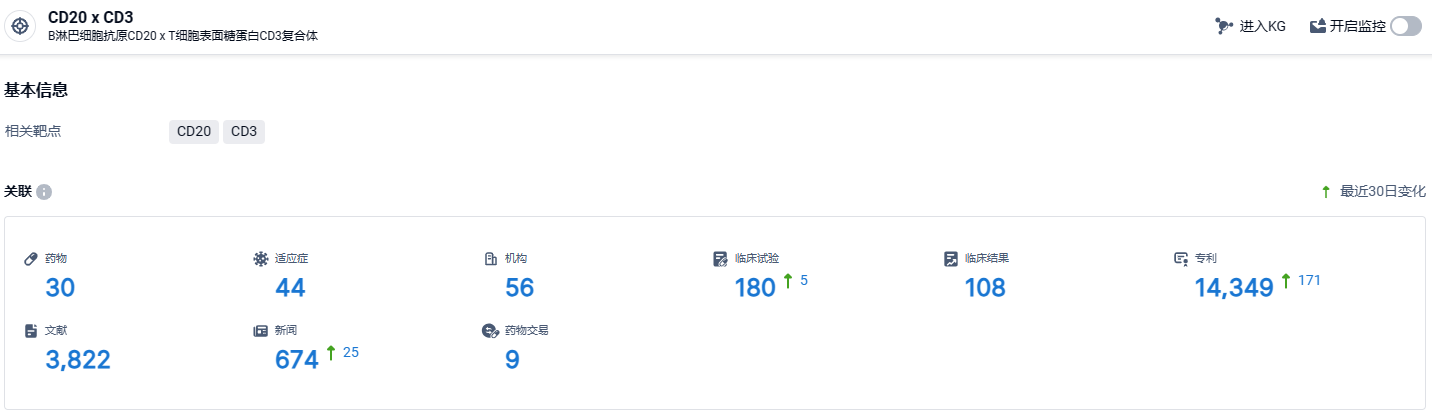
根据智慧芽新药情报库所披露的信息 (点击下方图片直达CD20 x CD3靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年6月28日,CD20 x CD3靶点共有在研药物30个,包含的适应症有44种,在研机构56家,涉及相关的临床试验180件,专利多达14349件……Epcoritamab(Epkinly)曾于2023年11月获得美国食品及药物管理局的突破性疗法认定。与此同时,突破性疗法认定也于2023年11月提交给了欧洲药品管理局(EMA)。该sBLA获得FDA批准,Epcoritamab成为首个也是唯一一个用于治疗既往接受过两轮治疗的R/RFL成年患者的双特异性抗体。这是该药继治疗R/R三线弥漫大B细胞淋巴瘤获得FDA和EMA批准后的第二个适应症。期待该药的后续发展。