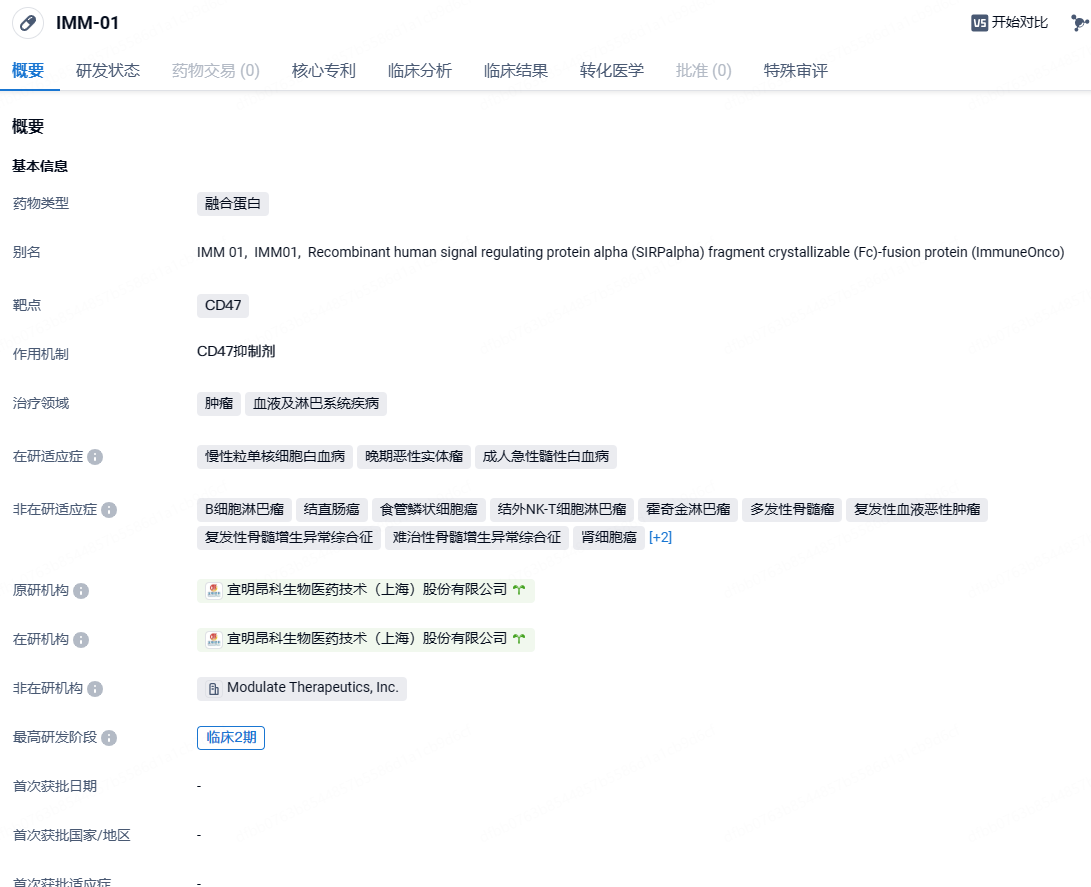
宜明昂科靶向CD47融合蛋白替达派西普联合疗法获批3期临床,针对霍奇金淋巴瘤
2024年4月17日,宜明昂科宣布,替达派西普(timdarpacept,研发编号:IMM01)联合抗PD-1单抗替雷利珠单抗的一项3期临床试验获中国国家药品监督管理局药品审评中心(CDE)批准,针对的适应症为:用于抗PD-(L)1单抗难治的经典霍奇金淋巴瘤(cHL)患者治疗。
替达派西普是基于宜明昂科自有研发平台研发、经基因修饰,并具有全球自主知识产权的新一代CD47靶向分子。替达派西普具有双重机制,能够同时阻断来自肿瘤的“别吃我”信号,并通过IgG1激活患者免疫系统的“吃我”信号。替达派西普在体内具有强大的抗肿瘤活性,临床上可以观察到单药的有效性。同时,在临床前体内药效试验中,替达派西普与靶向药物或免疫治疗药物联用,显示了针对血液肿瘤还有实体瘤的强大的抑瘤活性。替达派西普目前已分别在中国、日本、美国和欧盟获批发明专利。2023年11月8日,宜明昂科发布公告,FDA已授予靶向CD47的SIRPαFc融合蛋白IMM01联合阿扎胞甘治疗慢性粒单核细胞白血病(CMML)的孤儿药资格认定。
2023年12月,替达派西普用于治疗抗PD-(L)1抗体治疗失败后的cHL的2期临床研究结果已入选了2023年美国血液学会(ASH)年会口头报告。根据宜明昂科在2023 ASH会议现场报告的更新数据:替达派西普联合替雷利珠单抗治疗既往抗PD-(L)1抗体治疗失败后的cHL患者客观缓解率(ORR)达65.2%,完全缓解(CR)为17.4%,疾病控制率(DCR)为100%,而且在各个亚组分析中均显示可以从联合治疗中获益;另外,IMM01联合替雷利珠单抗治疗耐受性良好,没有患者发生因药物相关不良反应导致的永久停药情况。
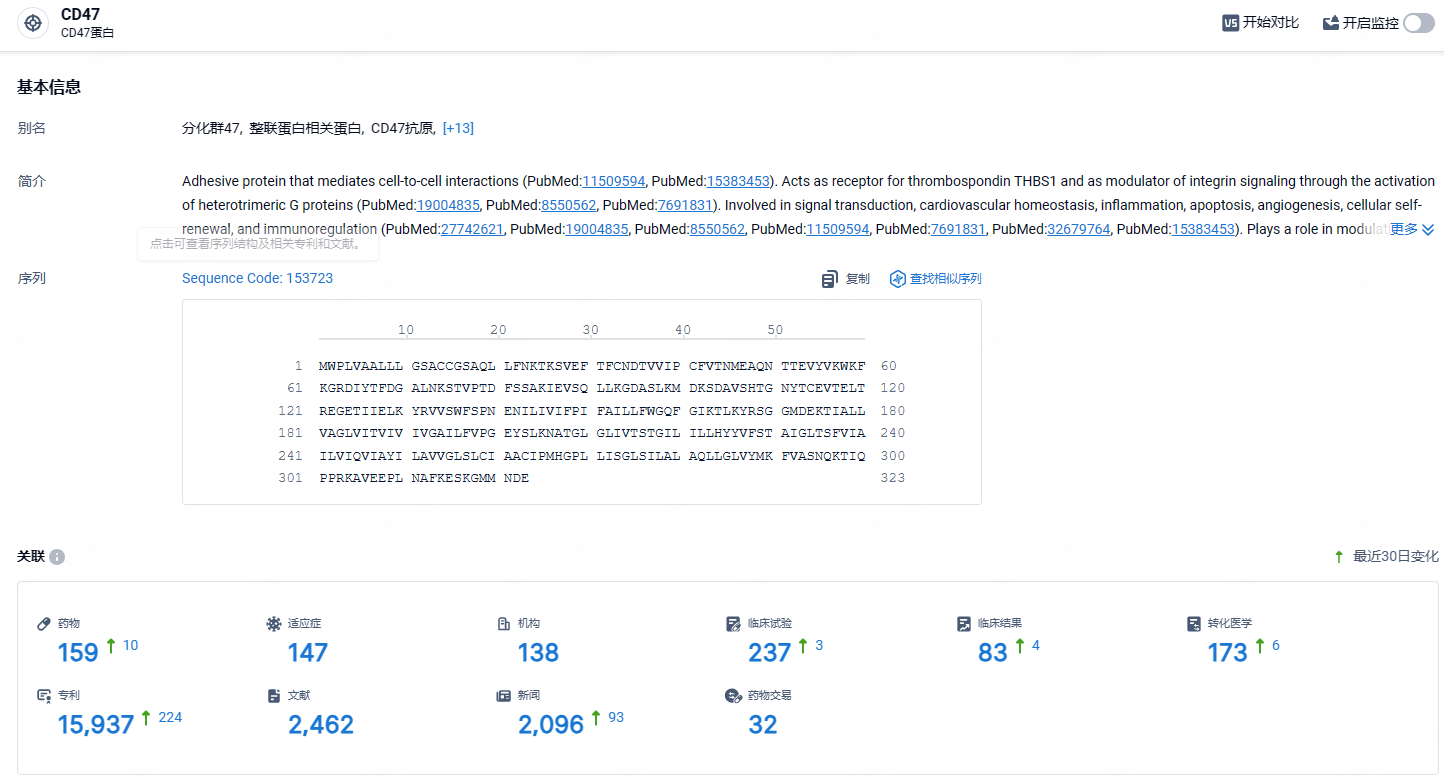
根据智慧芽新药情报库所披露的信息 (点击下方图片直达CD47靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年4月19日,CD47靶点共有在研药物159个,包含的适应症有147种,在研机构138家,涉及相关的临床试验237件,专利多达15937件……替达派西普与其它同一靶点药物的最大差异化就是完全避免了与红细胞的结合,不会引起严重贫血事件。同时由于糖基化修饰,大大降低了药物的免疫原性,改善了药物的PK,显著提高了药物的生物利用度。期待替达派西普后续研发顺利。