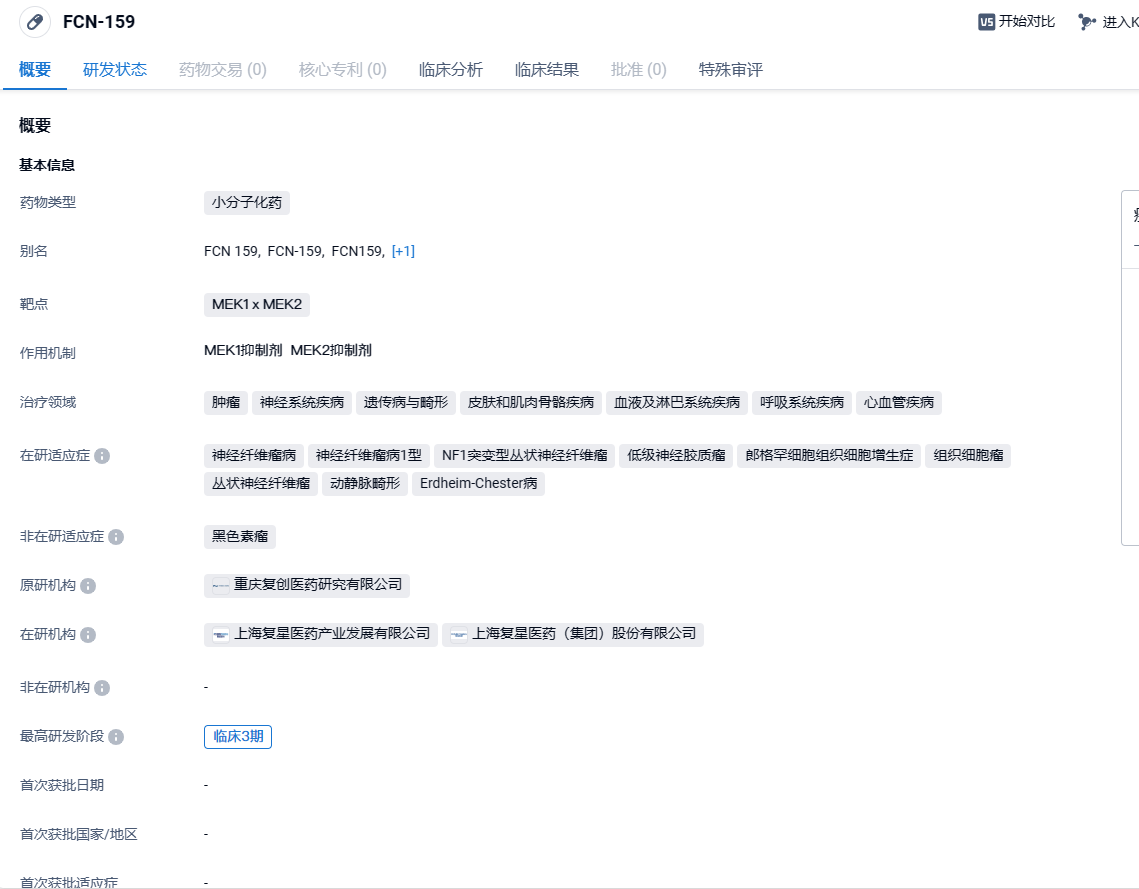
复星医药MEK1/2抑制剂FCN-159拟优先审评,针对树突状细胞和组织细胞肿瘤
2024年4月15日,CDE网站显示,复星医药的MEK1/2抑制剂FCN-159拟优先审评,用于治疗成人树突状细胞和组织细胞肿瘤。此前,该产品已被CDE授予两项突破性疗法,分别为:①用于治疗组织细胞肿瘤患者;②用于治疗无法手术或术后残留/复发的NF1(即I型神经纤维瘤)相关的丛状神经纤维瘤成人患者。
FCN-159是一种口服高效选择性MEK1 x MEK2抑制剂,是BRAF突变或RAS突变肿瘤的候选靶向治疗药物,它的选择性比曲美替尼高 10 倍。FCN-159是由重庆复创医药研究有限公司(复星医药子公司)开发,主要用于治疗遗传病与畸形、肿瘤,当前正在开发多种适应症,其中组织细胞瘤于2023年4月13日,首次获得NMPA突破性疗法认证;2023年7月17日,针对NF1突变型丛状神经纤维瘤,再次获得NMPA突破性疗法认证。 FCN-159未来很可能上市,并为患者提供新的治疗选择和希望。
2023年欧洲肿瘤内科学会(ESMO),FCN-159治疗MAPK通路激活的复发或进展性儿童低级别胶质瘤(pLGG)的Ⅱ期研究数据在大会上进行了公布。
截至2023年7月31日,本研究共纳入23例复发或进展性LGG患者,根据体表面积(BSA)给予FCN-159单药治疗(5mg/m2,每天一次)。主要终点是根据RANO标准评估FCN-159的初步疗效。
结果显示,入组时患儿的中位年龄为8岁(范围:3-17岁),56.5%为女性。所有患者均有BRAF或NF1变异(BRAF V600E,12/23,52.2%,KIAA1549-BRAF融合,8/23,34.8%,NF1突变,3/23,13.0%)。中位随访7.79个月时,22例患儿接受了疗效评估:6例部分缓解(PR,27.3%,未确认PR 3),9例轻微缓解(MR,40.9%,未确认MR 2),7例疾病稳定(SD,31.8%)。在安全性方面,23例患儿中,22例(95.7%)发生了治疗相关不良事件(TEAE),均与研究药物相关。最常见的TEAE(发生率≥20%)包括血乳酸脱氢酶升高、α-羟丁酸脱氢酶升高、血肌酸磷酸激酶升高、上呼吸道感染、甲沟炎和皮疹。大多数为1级或2级,2例报告为3级,无4级或以上报告。1例患者发生严重不良事件,表现为肝功能检查异常。16例患者发生了导致药物治疗中断的TEAE,其中10例与研究药物相关。未发生导致减药、停药或死亡的TEAE。
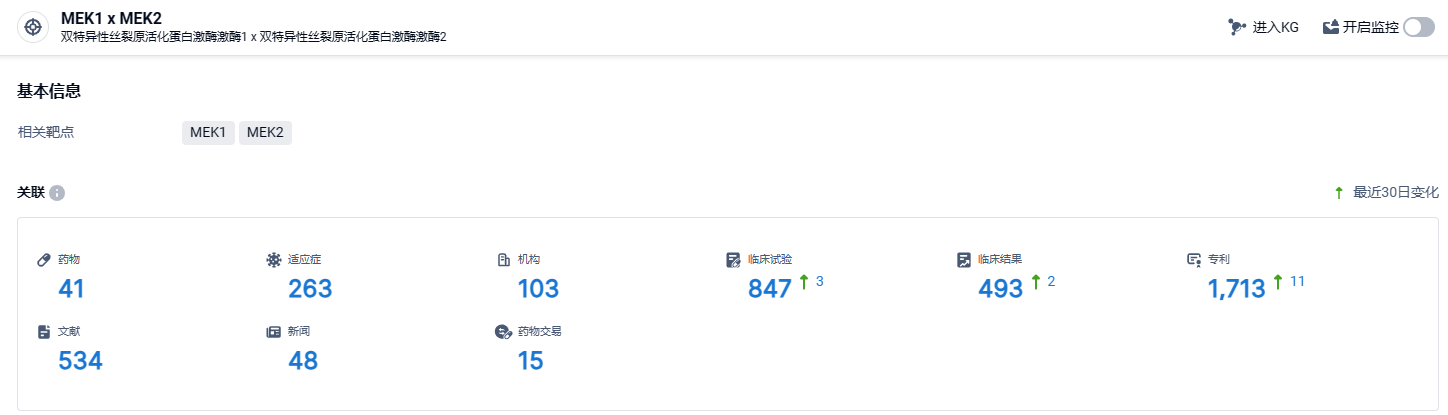
根据智慧芽新药情报库所披露的信息(点击下方卡片直达MEK1 x MEK2靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2024年4月17日,CFB靶点共有在研药物41个,包含的适应症有263种,在研机构103家,涉及相关的临床试验847件,专利多达1713件……复星医药已经启动了FCN-159片的一项3期临床研究,评估该产品单药治疗不可手术切除,或术后残留/复发的成人1型神经纤维瘤(NF1)相关的丛状神经纤维瘤患者的疗效和安全性。期待该药尽早上市,为神经纤维瘤患者带来的新的治疗选择。