预约演示
更新于:2025-05-07
Hemoglobin SC Disease
血红蛋白SC疾病
更新于:2025-05-07
基本信息
别名 Disease, Hemoglobin SC、Disease, SC、Diseases, Hemoglobin SC + [67] |
简介 One of the sickle cell disorders characterized by the presence of both hemoglobin S and hemoglobin C. It is similar to, but less severe than sickle cell anemia. |
关联
10
项与 血红蛋白SC疾病 相关的药物靶点 |
作用机制 PKLR激动剂 |
非在研适应症- |
最高研发阶段批准上市 |
首次获批国家/地区 美国 |
首次获批日期2022-02-17 |
靶点 |
作用机制 P-sel抑制剂 |
最高研发阶段批准上市 |
首次获批国家/地区 美国 |
首次获批日期2019-11-15 |
作用机制 P2Y12 receptor拮抗剂 |
最高研发阶段批准上市 |
首次获批国家/地区 欧盟 [+3] |
首次获批日期2009-02-24 |
73
项与 血红蛋白SC疾病 相关的临床试验NCT06924970
A Phase 2, Double-blind, Randomized, Placebo-Controlled, Multicenter, Dose- Finding, Efficacy, and Safety Study of Tebapivat in Participants With Sickle Cell Disease
The main purpose of this study is to compare the effect of tebapivat versus placebo on anemia and to detect a dose-response for hemoglobin (Hb) response in participants with SCD.
开始日期2025-05-06 |
申办/合作机构 |
NCT06886477
Exploring the Mediterranean Diet As a Promising Approach for Alleviating Chronic Pain in Sickle Cell Disease
The goal of this study is to compare pain levels in individuals with Sickle Cell Disease while following the Mediterranean Diet to pain levels while following their usual diet.
开始日期2025-05-01 |
申办/合作机构 |
NCT06930703
Treatment of Sickle Cell Pain and Inflammation With Cannabidiol (SPICe)
Randomized, placebo-controlled, double masked, dose finding study of twice daily cannabidiol given at 3 dose levels, 200mg, 400mg, and 600mg, compared to placebo for 4 weeks.
开始日期2025-04-01 |
100 项与 血红蛋白SC疾病 相关的临床结果
登录后查看更多信息
100 项与 血红蛋白SC疾病 相关的转化医学
登录后查看更多信息
0 项与 血红蛋白SC疾病 相关的专利(医药)
登录后查看更多信息
1,877
项与 血红蛋白SC疾病 相关的文献(医药)2025-08-01·Annals of Diagnostic Pathology
Clinicopathologic features of histologic transformation in lung adenocarcinoma after treatment with epidermal growth factor receptor-tyrosine kinase inhibitors
Article
作者: Jang, Se Jin ; Hwang, Hee Sang ; Song, Joon Seon ; Kim, Deokhoon ; Song, Halim
2025-05-01·International Orthopaedics
Arthroscopic management of knee synovial chondromatosis: a systematic review of outcomes and recurrence
Review
作者: Groszman, Lilly ; Alamiri, Nawaf ; Marwan, Yousef ; Al Farii, Humaid ; Burman, Mark ; Alfayez, Saud M
2025-04-08·Neurology
Neurodegeneration and Demyelination in the Multiple Sclerosis Spinal Cord
Article
作者: Mahajan, Kedar R. ; Androjna, Caroline ; Herman, Danielle ; Nakamura, Kunio ; Thoomukuntla, Bhaskar ; Ontaneda, Daniel ; Zheng, Yufan ; Trapp, Bruce D.
7
项与 血红蛋白SC疾病 相关的新闻(医药)2025-04-28
·仁度生物
3月,2025年亚太肝病会议在中国北京成功召开,在此为大家总结了有患HBV RNA的最新研究成果,主要是HBV RNA评估新药ALG-000184的数据以及在慢性乙型肝炎抗病毒治疗中的临床价值,这些崭新的研究成果为开发、研究HBV治疗策略注入了新鲜的血液。3月,2025年亚太肝病会议在中国北京成功召开,在此为大家总结了有患HBV RNA的最新研究成果,主要是HBV RNA评估新药ALG-000184的数据以及在慢性乙型肝炎抗病毒治疗中的临床价值,这些崭新的研究成果为开发、研究HBV治疗策略注入了新鲜的血液。1Monotherapy with the Capsid Assembly Modulator ALG-000184 Results in High Viral Suppression Rates in Untreated HBeAg+ Subjects with Chronic Hepatitis B Virus InfectionALG-000184单药治疗在未经治疗的HBeAg阳性慢性乙型肝炎病毒感染者中实现高病毒抑制率作者:Man Fung Yuen, Kosh Agarwal, Alina Lucov, Alexei Haceatrean, Min Wu, Kha Le, Thanh Van, Jen Rito, Lawrence Blatt, Sushmita Chanda, Tse I Lin, Hardean Achnec, Ed Gane单位:Queen Mary Hospital, The University of Hong Kong, King‘s College Hospital内容摘要背景:ALG-000184是ALG-001075的前体药物,后者是一种高效衣壳组装调节剂(CAM-E)。体外研究显示,ALG-001075可诱导空衣壳形成、抑制HBV复制并阻止cccDNA的建立/补充。方法:ALG-000184-201是一项多阶段、多中心、随机临床试验(NCT04536337),旨在评估ALG-000184在健康志愿者和未经治疗的慢性HBV感染者中的安全性、药代动力学及抗病毒活性。本文报告了接受300毫克ALG-000184单药治疗≤92周的未经治疗HBeAg阳性受试者的安全性和抗病毒活性数据。结果:10例未经治疗的HBeAg阳性慢性HBV感染者(9例亚洲人,1例非亚洲人)接受了长达92周的300毫克ALG-000184单药治疗。HBV基因型为B型(5例亚洲人)、C型(4例亚洲人)和D型(1例非亚洲人)。平均(SEM)ALT水平为60.7(11.7)U/L;HBV DNA、HBV RNA、HBsAg、HBeAg和HBcrAg的基线平均值(SEM)分别为8.0(0.2)log10 IU/mL、5.3(0.4)log10拷贝/mL、4.3(0.1)log10 IU/mL、2.3(0.2)log10 PEI U/mL和8.3(0.2)log10 U/mL。至第92周时,HBV DNA、HBV RNA、HBsAg、HBeAg和HBcrAg的最大平均降幅分别为7.3 log10 IU/mL、5.5 log10拷贝/mL、1.2 log10 IU/mL、1.7 log10 PEI U/mL和2.6 log10 U/mL。第48、72和84周时,分别有6/10(60%)、8/9(89%)和7/7(100%)的HBeAg阳性受试者实现HBV DNA持续<10 IU/mL(定量下限)。所有受试者至第44周时HBV RNA持续<10拷贝/mL(定量下限)。HBeAg显著下降及抗-HBe抗体水平升高表明HBeAg消失呈持续积极趋势。截至92周单药治疗期间,未观察到病毒突破(基于HBV DNA水平)。结论:300毫克ALG-000184单药治疗在未经治疗的HBeAg阳性受试者中实现了快速、显著且持久的HBV DNA和RNA病毒抑制,其效果超过既往核苷(酸)类似物的报告数据,提示ALG-000184单药治疗可能更有效实现并维持慢性HBV感染的病毒抑制。这些数据支持将该队列治疗延长至96周,并在II期临床试验中进一步评估。2Monotherapy with the Capsid Assembly Modulator ALG-000184 Results in Rapid Viral Load Reduction and High Viral Suppression Rates in Untreated HBeAg(-) Subjects with Chronic Hepatitis B Virus InfectionALG-000184单药治疗在未经治疗的HBeAg阴性慢性乙型肝炎病毒感染者中实现快速病毒载量下降和高病毒抑制率作者:Ed Gane, Kosh Agarwal, Alina Jucov, Alexei Haceatrean, Min Wu, Kha Le, Thanh Van, Jen Rito, Lawrence Blatt, Sushmita Chanda, Tse I Lin, Hardean Achneck, Man Fung Yuen单位:University of Auckland, New Zealand, King‘s College Hospital内容摘要背景:ALG-000184是ALG-001075的前体药物,后者是一种高效的空衣壳组装调节剂(CAM-E)。体外实验表明,ALG-001075可诱导空衣壳形成、抑制乙型肝炎病毒(HBV)复制,并阻止共价闭合环状DNA(cccDNA)的建立或补充。方法:ALG-000184-201是一项多阶段、多中心、随机临床试验(NCT04536337),旨在评估ALG-000184在健康志愿者和未经治疗的慢性HBV感染者中的安全性、药代动力学及抗病毒活性。本文报告了接受300毫克ALG-000184单药治疗≤84周的未经治疗HBeAg阴性受试者的安全性和抗病毒活性数据。结果:共11例未经治疗的HBeAg阴性慢性HBV感染者(3例亚洲人,8例非亚洲人)接受了长达84周的300毫克ALG-000184单药治疗。HBV基因型为B型(2例)、C型(1例)、A型(1例)和D型(7例)。HBV DNA、HBV RNA、HBsAg和HBcrAg的基线平均值(SEM)分别为4.3(0.2)log10 IU/mL、2.0(0.3)log10拷贝/mL、3.5(0.2)log10 IU/mL和3.2(0.3)log10 U/mL。至第84周时,HBV DNA和HBV RNA的最大平均降幅分别为4.3 log10 IU/mL和1.0 log10拷贝/mL。所有HBeAg阴性受试者在第24周前均实现HBV DNA持续抑制。第48周时,11/11(100%)受试者HBV DNA持续<10 IU/mL(定量下限),10/11(91%)受试者HBV DNA<4.29 IU/mL(检测下限)。所有受试者至第8周时HBV RNA持续<10拷贝/mL(定量下限)。尽管未观察到HBsAg明显下降,但HBcrAg的最大平均降幅为0.7 log10 U/mL。重要的是,所有受试者均未出现病毒突破(基于HBV DNA水平评估)。结论:300毫克ALG-000184单药治疗在未经治疗的HBeAg阴性受试者中实现了快速、显著且持久的HBV DNA和RNA病毒抑制,其效果超过既往核苷(酸)类似物的报告数据,表明ALG-000184单药治疗可能更有效实现并维持慢性HBV感染的病毒抑制。这些数据支持将该队列治疗延长至96周,并在II期临床试验中进一步评估。3Clinical value of serum HBV RNA in patients with chronic hepatitis B during antiviral therapy血清HBV RNA在慢性乙型肝炎抗病毒治疗中的临床价值作者:Xiaojing Zhang, Fengmin Lu, Rui Wu, Qiaofei Jin, Yijun Zhou, Chen Wang, Huaguo Shao, Shourong Liu单位:杭州西溪医院内容摘要背景:抗病毒治疗期间HBV RNA与HBV DNA、HBsAg的相关性及其对停药时机的指导意义尚不明确。本研究旨在探讨HBeAg阳性CHB患者抗病毒治疗中HBV RNA定量检测的临床意义,并明确其对HBeAg血清学转换(SR)的预测价值。方法:纳入2022年1月至12月新诊断的138例HBeAg阳性CHB患者,分为HBeAg SR组和非血清学转换(NSR)组,分析两组HBV RNA、HBV DNA、HBsAg和HBeAg的动态变化及相关性,并评估其对HBeAg SR的预测效能。发生HBeAg血清学转换定义为SR,未发生HBeAg血清学转换定义为NSR。结果:HBeAg SR率为23.9%(33/138),TAF治疗组SR率显著高于其他药物(P<0.001)。SR组治疗后血清HBV RNA水平较NSR组显著下降。基线HBV RNA与HBV DNA、HBsAg和HBeAg显著相关,但治疗后相关性减弱。单因素及多因素回归分析显示,第12周血清HBV RNA水平是HBeAg SR的独立预测因子。第12周HBV RNA的受试者工作特征曲线下面积(AUROC)为0.8039(95% CI: 0.6910-0.917),截断值为5.68 lg拷贝/mL时,敏感性和特异性分别为76.47%和72.55%。结论:HBeAg阳性CHB患者基线HBV RNA与HBV DNA及HBsAg显著正相关,但抗病毒治疗后相关性减弱。第12周HBV RNA水平可作为HBeAg SR的早期预测指标,TAF治疗组HBeAg SR率高于ETV和TDF组。往期回顾前沿速递| 2025 APASL HBV RNA精彩荟萃(一)前沿速递 | 2月病原体RNA研究新进前沿速递 | 1月病原体RNA研究新进关于仁度上海仁度生物科技股份有限公司(股票代码:688193)成立于2007年,是国内最早一批专注于RNA分子诊断技术和产品的生命科学企业之一,致力于开发临床需求尚未满足的创新诊断技术和产品。公司拥有RNA实时荧光恒温扩增(SAT)的独家专利技术平台,以该技术平台为基础自主研发了一系列分子诊断试剂和设备一体化产品,专注于为生殖、呼吸、消化、血液、食品、环境安全等领域病原体的精准诊断、有效防控和个性化诊疗提供解决方案。仁爱生命 度衡健康专注病原体RNA临床检测
临床结果临床研究
2025-03-23
中华医学会肝病学分会肝炎学组和中华肝脏病杂志编辑委员会于2024年6月发表了《加速消除乙型肝炎病毒感染:扩大预防和治疗专家建议》(下称《专家建议》),对于包括慢乙肝全人群筛查、成人乙型肝炎疫苗接种、乙型肝炎病毒(HBV)DNA定量值的评价、启动抗病毒治疗的丙氨酸转氨酶(ALT)阈值、“不确定期”患者的治疗等《2022版乙肝防治指南》未达成共识的亟需解决的热点、难点问题进行了梳理,结合全球研究进展,提出建议。该建议旨在通过进一步扩大乙型肝炎的预防和治疗,早日实现世界卫生组织提出的“2030年消除病毒性肝炎作为公共卫生危害”的目标。本文就《专家建议》的要点进行介绍和解读,指导临床医生加强乙型肝炎的筛、诊、治、管。
1 一般人群HBV感染筛查、检测和管理
HBV本身不直接造成肝细胞损伤,而且肝脏本身再生及代偿功能较强,因此慢性HBV感染者一般不会出现明显的临床表现、肝功能可能长期在正常范围内。因此,慢性HBV感染的诊断主要依靠血清学和病毒学检测。根据Polaris发布的中国消除乙型肝炎进展数据,中国慢性HBV感染人数为7974.2万,诊断率仅仅为24%,治疗率更低,仅仅为15%。扩大人群筛查是实现早期诊断和及时治疗的关键措施之一。《专家建议》提出,对于≥18岁人群一生至少检测1次;持续暴露危险因素的高危人群应定期检测;检测项目包括乙型肝炎表面抗原(HBsAg)、乙型肝炎表面抗体(抗-HBs)和乙型肝炎核心抗体(抗-HBc)3项指标。
筛查后的临床管理也至关重要。筛查后临床管理包括诊断、疾病严重程度评估和抗病毒治疗。与现行HBV筛查策略比较,普遍筛查联合筛查后50%临床管理,到2030年,新发肝细胞癌(HCC)将减少7.3%,慢性乙型肝炎死亡将减少8.5%,累积HBV相关死亡将减少5%。《专家建议》提出,筛查结果HBsAg阳性者应进一步评估和治疗。特别指出,抗-HBs和抗-HBc同时阳性或单项抗-HBc阳性者,需进一步检测HBV DNA载量。3项均阴性者,建议接种乙肝疫苗。
2 成人乙型肝炎疫苗接种
以2013—2020年中国法定传染病报告系统中报告的乙肝病例为依据,对发病情况进行估算,2013—2020年中国估计急性乙肝发病率为4.6/10万,其中31~60岁发病占65.5%(2158/3297)。而且乙肝疫苗安全性高、可及性高。因此《专家建议》提出,建议无乙型肝炎疫苗接种史的≥18岁人群接种乙肝疫苗,特别是有乙肝高危因素的人群更应该接种;此外明确指出成人接种乙肝疫苗剂量及接种程序,首次接种后无应答人群应如何再次接种。
3 HBV DNA定量检测结果评价
检测HBV DNA应该采用高灵敏、具有更低检测下限(<10~20 kU/L)、更广线性范围(10~108~9 kU/L)的检测方法,以及时发现低病毒载量患者给予及时治疗,或及时发现治疗效果不佳患者及时给予调整治疗策略。HBV DNA定量检测试剂有的检测下限(LLOD)和定量下限(LLOQ)不同,简单说前者的HBV DNA载量较后者更低。《专家建议》指出,判断疾病自然史分期、启动抗病毒治疗、判断抗病毒治疗效果等应用的HBV DNA值,均以LLOQ为标准,认为只有检测到HBV DNA定量值,方可定为阳性。
4 ALT正常值上限与治疗阈值
各大指南对ALT的正常值均有不同推荐,大多数建议男性ALT正常值为30 U/L、女性为19 U/L;2018年AASLD指南建议男性ALT正常值为35 U/L,女性为25 U/L;而EASL和APASL指南建议男女ALT正常值均为40 U/L。2015年APASL指南定义了正常高值ALT,为0.5~1倍的正常值上限(ULN)。由于正常高值ALT的慢性乙型肝炎患者,肝组织学病变比例更高、肝病相关不良结局发生率更高,因此《专家建议》提出以正常高值作为ALT治疗的阈值,扩大治疗人群,可显著改善这部分患者肝病长期预后。
5 HBsAg阴性的乙型肝炎肝硬化患者抗病毒治疗策略
Kim等对829例HBsAg清除的慢性HBV感染者的回顾性研究发现,经3464人年的随访,肝硬化患者HCC年发生率为2.85%,显著高于非肝硬化患者(0.29%)。《专家建议》指出,对于HBsAg阴性的乙型肝炎肝硬化患者,都应该继续抗病毒治疗,争取肝硬化逆转或再代偿。对于功能性治愈的乙肝肝硬化患者,应继续治疗至肝硬化逆转;隐匿性乙型肝炎肝硬化患者(血清或肝组织HBV DNA阳性),应立即开始抗病毒治疗;HBV Pre-S/S突变株感染导致的乙肝肝硬化患者,如HBV DNA检测阳性,建议立即治疗,如HBV DNA阴性,应肝活检后决定是否抗病毒治疗。
6 临床(功能性)治愈的优势人群
由于聚乙二醇干扰素(PegIFN)α相比于核苷类似物(NAs),不良反应相对较多,目前仍建议选择优势人群采用Peg-IFN α单药或联合治疗。目前中国很多研究探讨经治或初治慢乙肝患者Peg-IFN α治疗的临床治愈率,并推荐优势人群。“珠峰项目”5年数据报告,NAs经治的基线HBsAg≤500 kU/L慢乙肝患者,联合Peg-IFN α治疗至48周,HBsAg清除率为42.9%。“破冰项目”2年数据显示,初治乙型肝炎e抗原(HBeAg)阴性、ALT正常慢性HBV感染者,如基线HBV DNA<1000 kU/L,HBsAg<500 kU/L,Peg-IFN α治疗48周临床治愈率高达52.4%。基于此,《专家建议》推荐了临床治愈的优势人群。
7 “不确定期”的定义及其治疗策略
“不确定期”患者难以被自然史分期明确分期,主要包括不能明确区分HBeAg阳性慢性HBV感染者与HBeAg阳性慢性乙型肝炎(CHB)患者,以及不能明确区分HBeAg阴性HBV感染者与HBeAg阴性CHB患者。相较于真正的免疫耐受期或非活动期人群,这部分患者疾病进展风险相对较高,也可能需要抗病毒治疗。《专家建议》指出,HBeAg阳性“不确定期”患者,建议做肝活检,根据组织学改变或无创检测评估决定是否抗病毒治疗;HBeAg阴性“不确定期”患者,只要HBV DNA阳性,建议抗病毒治疗。
8 合并感染和并发症患者的抗病毒治疗
关于HBV感染者同时存在人类免疫缺陷病毒、丙型肝炎病毒、丁型肝炎病毒感染的情况,很多研究分析比较了单独感染和合并感染患者的不良临床结局的发生情况,研究结果提示合并其他病毒感染的HBV感染者肝功能更差、肝硬化及肝癌发生率更高。存在代谢相关危险因素的患者,包括肥胖、高血压病、高脂血症、糖尿病,代谢危险因素与HCC发生正相关。因此,《专家建议》提出,对于合并其他病毒感染及代谢相关危险因素的慢性HBV感染者,应积极抗病毒治疗。
除了以上8个部分的建议以外,《专家建议》推荐简化的慢乙肝治疗理念,优先评估HBV DNA和血清学指标,然后考虑ALT和患者年龄,再考虑家族史和疾病严重程度及进展风险,另外在抗病毒治疗的同时,要联合抗纤维化治疗。《专家建议》的目的在于成人进行普遍筛查,科学地指导未感染者乙型肝炎疫苗接种;对HBV感染者进行评估、治疗和长期随访管理,最大限度地让新版指南中关于扩大抗病毒治疗的理念得以惠及更多患者,让符合适应证的患者尽早启动治疗,向乙型肝炎全治迈进一大步。
相关阅读
23%乙肝患者达到临床治愈!NEJM:侯金林领衔新疗法,探索停药后持续“清除”病毒
中国乙肝患者约7500万!《柳叶刀》子刊:约3000万人不知晓已感染
《柳叶刀》子刊:停药后持续“清除”乙肝感染24周,创新药助力功能性治愈
全球乙肝感染者,65%在亚太地区!《自然》子刊:关注8大关键策略
向治愈乙肝进发!95%中国患者需考虑抗病毒治疗,4类人群应尽快治疗
欢迎投稿:学术成果、前沿进展、临床干货等主题均可,点此了解投稿详情。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
分享,点赞,在看,传递医学新知
疫苗临床研究
2025-03-12
·医药速览
北京时间2025年2月20日,西湖大学未来产业研究中心、生命科学学院、西湖实验室卢培龙课题组,在Nature杂志在线发表题为De novo design of transmembrane fluorescence-activating proteins的科研报道——他们首次实现了跨膜荧光激活蛋白的从头设计,这也是第一个通过人工设计得到的能够非共价结合特定小分子的跨膜蛋白1。
论文截图
看到黑色粗体字的文章标题在杂志官网上刷新出来,卢培龙长舒一口气:
“一年了……”
2023年9月,卢培龙初次将这项成果投给Nature。经过漫长的五个月等待,他在龙年春节前夕收到了编辑发来的回复:三位审稿人的意见出现了严重的两极分化。
他沮丧极了,觉得这个年没法过了。
2024年8月,他们完成了审稿人认为“天知道”能不能做成的补充实验,再次将这篇文章投了出去;蛇年春节前夕,终于等来了“即将发表”的好消息。
所以,接下来的内容,不仅要讲这个课题,我们更想讲一讲课题背后的人,讲一讲他们被“磨”了五年、十年,甚至更长时间的故事。
在这个故事里,你将真实地看到:科研的路,不知道需要多少步,但每一步都算数。
铺垫
卢培龙很早就盯上了 “跨膜蛋白”。
顾名思义,跨膜蛋白“跨”在细胞膜上,如果将细胞膜看作城墙的话,膜蛋白就是进出城市的城门,细胞内外的物质交换、信息传递,都要通过各种各样的膜蛋白来完成。人类基因组编码的所有蛋白质中,有超过四分之一是膜蛋白。
人体的五种感觉——视觉、听觉、触觉、味觉和嗅觉——都依赖于膜蛋白的关键作用。拿视觉来说,人视网膜视锥细胞中的视紫红质(rhodopsin),是人类直接感受光信号的分子,它结合作为感光基团的视黄醛(retinal),并借助视黄醛分子光致变构的特性,对外界的光信号作出响应,从而使人类能够看见多姿多彩的大千世界。
作为细胞生命活动的核心部件,膜蛋白的功能一旦出现异常,细胞乃至整个生命体的生理活动就容易出问题,各种疾病也便随之而来。目前世界上大约一半现代药物的靶标分子都属于膜蛋白。在许多常见的心血管疾病、精神类疾病,以及更难治疗的癌症、阿尔茨海默症等疾病中,都能够找到与其密切相关的膜蛋白分子,增强或抑制这些膜蛋白的功能,很可能成为治疗疾病的关键。
“那么是否有可能通过人工设计来按需定制全新的、理想的膜蛋白呢?”
它或许可以执行更多更复杂的定制化功能,或许可以更准确地辨别敌友信号,或许可以更高效地进行光合作用……
逢山开路,遇河架桥。大自然没有提供答案的角落,正是想象力和创造力绽放的空间。
大自然中,不同氨基酸序列的肽链能够通过折叠形成不同的结构,从而产生不同的功能;而蛋白质从头设计的过程实际上是将这个流程倒过来,先预设需要的功能和对应的结构,再反推折叠出这个结构所需要的氨基酸序列。
跨膜骨架蛋白质2结构示意图
跨膜孔蛋白3结构示意图
10年前,卢培龙加入了华盛顿大学蛋白质设计研究所——也就是2024年诺贝尔化学奖获得者David Baker的课题组——开启了一段长达5年的博士后研究。2018年,也就是入组的第四年,他在世界上首次实现了对多次跨膜蛋白的精确从头设计2。该研究采用了多条螺旋状的结构作为蛋白骨架,与天然存在的跨膜蛋白的常见架构相符合。
这项工作标志着对膜蛋白的精确设计的起步。也因为尚在起步阶段,当时设计的膜蛋白只有结构,没有生理功能。
2019年,卢培龙回国,全职加入西湖大学生命科学学院,组建了自己的课题组——蛋白质设计实验室。2020年8月,Nature报道了由他与David Baker团队合作完成的最新研究——全球首次实现对跨膜孔蛋白的精确从头设计3。
如果说2018年第一步的尝试只是架起了桥,还没有通车;那么这一次的进步就在于,这座桥可以通车了。他们设计的跨膜孔结构,具备了离子、小分子转运通道的功能。
亮了!
这次在Nature发表的新工作,是卢培龙在2019年回国后开展的,一作朱璟熠是2019级博士研究生。他入学的时候,实验室才刚刚“开张”,他跟着卢老师从买试剂买设备开始,想尽快把这个课题启动起来。
他们的目标,是从头设计一种能够特异性地结合某种小分子的跨膜蛋白。这好比在生物膜环境中创造了一个独特的“泊位”,只能允许特定类型的“船舶靠岸”停放。
视紫红质三维结构,中心视黄醛分子显示为橙色4。
前面提到的人类直接感受光信号的视紫红质,就是因为具有能够特异结合视黄醛分子的“泊位”,才能够发挥感光的作用。这里“特异结合”的结构,被形象地称为“结合口袋(binding pocket)”。不同膜蛋白的“结合口袋”能够根据其独特的结构,来识别、结合与之相匹配的特定配体,从而实现特定的功能。比如葡萄糖转运蛋白转运葡萄糖分子进入人体细胞,为细胞提供能量;或者NMDA受体被氯胺酮药物分子抑制,对抑郁症起到治疗的作用。
课题组计划在从头设计的蛋白内部也构建一个这样的“口袋”,来特异性地结合目标配体分子。
跨膜荧光激活蛋白结构示意图
作为结合目标的小分子,他们也选好了——一种名叫HBC的荧光基团。这种分子在游离状态下并不会发光,只有当以特定姿态被稳定结合,才能发出荧光。如果成功,这项技术有望广泛应用在膜成像、跨膜传感器、跨膜物质传输等领域。
选择荧光基团作为目标配体分子还有另外一个理由。
在上一次设计“跨膜孔蛋白”的时候,为了验证那些离子究竟是不是从设计好的通道蛋白中透过去的,需要用复杂的测试体系才能得到强有力的证据,这一过程花费了课题组大量的时间。
而如果选择会发光的分子,亮了即代表成功,一目了然。
设计过程分为两步——先设计一个水溶性、不跨膜的简易版;成功后,再将其改造成跨膜蛋白。
研究人员打磨了数不清的设计版本,终于成功构建出了这样一个“口袋”,它不仅成功地结合(点亮)了配体荧光基团HBC599,而且结合后的荧光强度是游离状态的上千倍,远超天然跨膜荧光蛋白。
到这一步,他们花了3年的时间。
三年来,每周一次组会汇报,朱璟熠的电脑里一共存下了上千页PPT。
“因为小分子结合蛋白对精度的要求极高,成功的设计与失败的设计之间,有时只有0.1纳米的偏差。”这个从英国帝国理工学院硕士毕业的小伙子,倒是比导师更沉得住气。“不急,因为随着设计策略的不断改进,我的设计精度一直在不断地提高,趋势是好的。”
跨膜蛋白选择性激活特定荧光分子
再后来的一年,研究人员们一方面稳住好不容易得来的“口袋”结构,另一方面把蛋白表面从“亲水”设计成“疏水”,最终得到了一个“跨膜”版本的荧光激活蛋白。
这一次足足亮了1600倍!
挫折
“这个领域发展太快了!”
即便做了五年才完成这个课题,但朱璟熠反复挂在嘴边说的,却是这样一句话。
这五年里,技术变化翻天覆地,是动不动就能“上头条”的级别,去年的诺贝尔化学奖也颁发给了这一领域。
David Baker与卢培龙合影
(摄于斯德哥尔摩,2024年12月9日,诺贝尔奖颁奖前一天)
朱璟熠一边做课题,一边前排围观了导师的导师David Baker与人工智能巨头DeepMind在蛋白质结构预测赛道上的你追我赶;同时也见证和参与了人工智能技术对于蛋白质设计领域的革新,在自己的课题里展示了深度学习方法可以被运用到跨膜蛋白计算设计当中,极大地提高了设计的精度和效率。
这波技术跃迁,朱璟熠当然是受益者,但也差点沦为“炮灰”。
2023年9月,卢培龙最后一轮修改完文章,正式向Nature投稿。龙年春节前夕,编辑发回三位匿名审稿人的意见,评价两极化非常严重——
一位说,这是蛋白质设计领域里的杰作(masterpiece of protein design),推荐发表。
另一位评审人则认为,这是一篇很好的工作,第一次解决了领域内非常具有挑战性的问题;同时也提出为了让这项研究“闭环”,应该再补上设计的跨膜蛋白实验结构解析,证明它和设计模型是一致的。
第三个评审意见却是相对负面,同样提出了实验结构验证的问题,但因为蛋白质设计领域的快速发展,这位评审人对之前的研究进展有些误解。
一项快速发展的技术,一个全新的、炙手可热又鲜有先例可循的领域,一个年轻的科学家。这样的组合之下,Nature编辑选择往后退一步,但卢培龙和朱璟熠,不想退。
再投稿
对设计的跨膜荧光蛋白进行实验结构解析,为这个课题保留了一线生机,但也仅仅只有“一线”而已。
冷静下来之后,卢培龙也认可这个审稿意见。“此前确实有很多人尝试设计膜蛋白,也不乏一些有意思的结果,但最大的问题在于它们很难形成稳定的三维结构,缺乏结构上的验证,又或者很难做到实验中获得的结构与设计模型一致。”
事实上,在投稿前几个月,他们已经开始“解结构”了。只是由于这个蛋白质太小了,超过了冷冻电镜解析的极限,课题组也尝试了X-射线晶体学,但是膜蛋白结晶又十分困难。
在加入David Baker实验室之前,卢培龙在清华大学读博士,师从施一公,学的正是结构生物学,这是他的老本行。他甚至有可能是蛋白质设计这个领域里,最清楚跨膜蛋白结构解析有多难的那个人。
显然,那位审稿人也清楚其中的关窍,他的审稿意见里还有这样一句话:“这个结构的实验解析非常具有挑战性,能不能解出来,得看天意(in the lap of the gods)……”
“不管是结构生物学,还是蛋白质设计,我都是在全世界最强的实验室里学的。”卢培龙是这样给自己打气的,最后竟从中觅得了解题思路。“我们的跨膜荧光蛋白太小了,可以用蛋白质设计的方法把它变大呀!”
没想到,在清华大学和华盛顿大学学到的不同的知识,在多年以后产生了如此奇妙的融合,成了决胜的关键。
跨膜荧光激活蛋白冷冻电镜结构示意图
2024年9月,距离上一次投稿正好一年。课题组成功解析出设计蛋白与荧光基团复合物的高分辨率冷冻电镜结构,证实其与设计模型高度一致。
卢培龙把修改完善后的文章,再次发给了那位编辑。
这一次,三位审稿人都给出了正面意见。
从头设计跨膜荧光激活蛋白模型
“让最好的技术为我所用,去挑战不可能的事。”卢培龙说。
这是他从施一公和David Baker两位导师身上学到的最重要的一课——敢于做最前沿的研究,敢于挑战别人避之不及的困难——要敢为人先!
致谢
博士生朱璟熠(右一)、梁明福(左二)、孙科(左一)为本文共同第一作者,研究员卢培龙(右二)为通讯作者。
Ref.
1.J. Zhu et al., De novo design of transmembrane fluorescence-activating proteins. Nature, (2025).
2.2. P. Lu et al., Accurate computational design of multipass transmembrane proteins. Science 359, 1042-1046 (2018).
3. C. Xu et al., Computational design of transmembrane pores. Nature 585, 129-134 (2020).
4.K. Palczewski et al., Crystal structure of rhodopsin: A G protein-coupled receptor. Science 289, 739-745 (2000).
信息来源:西湖大学官网
链接:https://www.westlake.edu.cn
原文链接:https://www.nature.com/articles/s41586-025-08598-81.
推文用于传递知识,如因版权等有疑问,请于本文刊发30日内联系医药速览。
原创内容未经授权,禁止转载至其他平台。
有问题可发邮件至yong_wang@pku.edu.cn获取更多信息。
©2021 医药速览 保留所有权利
往期链接
“小小疫苗”养成记 | 医药公司管线盘点
人人学懂免疫学 | 人人学懂免疫学(语音版)
综述文章解读 | 文献略读 | 医学科普 | 医药前沿笔记
PROTAC技术 | 抗体药物 | 抗体药物偶联-ADC
核酸疫苗 | CAR技术 | 化学生物学
温馨提示
医药速览公众号目前已经有近12个交流群(好学,有趣且奔波于医药圈人才聚集于此)。进群加作者微信(yiyaoxueshu666)或者扫描公众号二维码添加作者,备注“姓名/昵称-企业/高校-具体研究领域/专业”,此群仅为科研交流群,非诚勿扰。
简单操作即可星标⭐️医药速览,第一时间收到我们的推送
①点击标题下方“医药速览”
②至右上角“...” ③点击“设为星标
核酸药物
分析
对领域进行一次全面的分析。
登录
或
生物医药百科问答
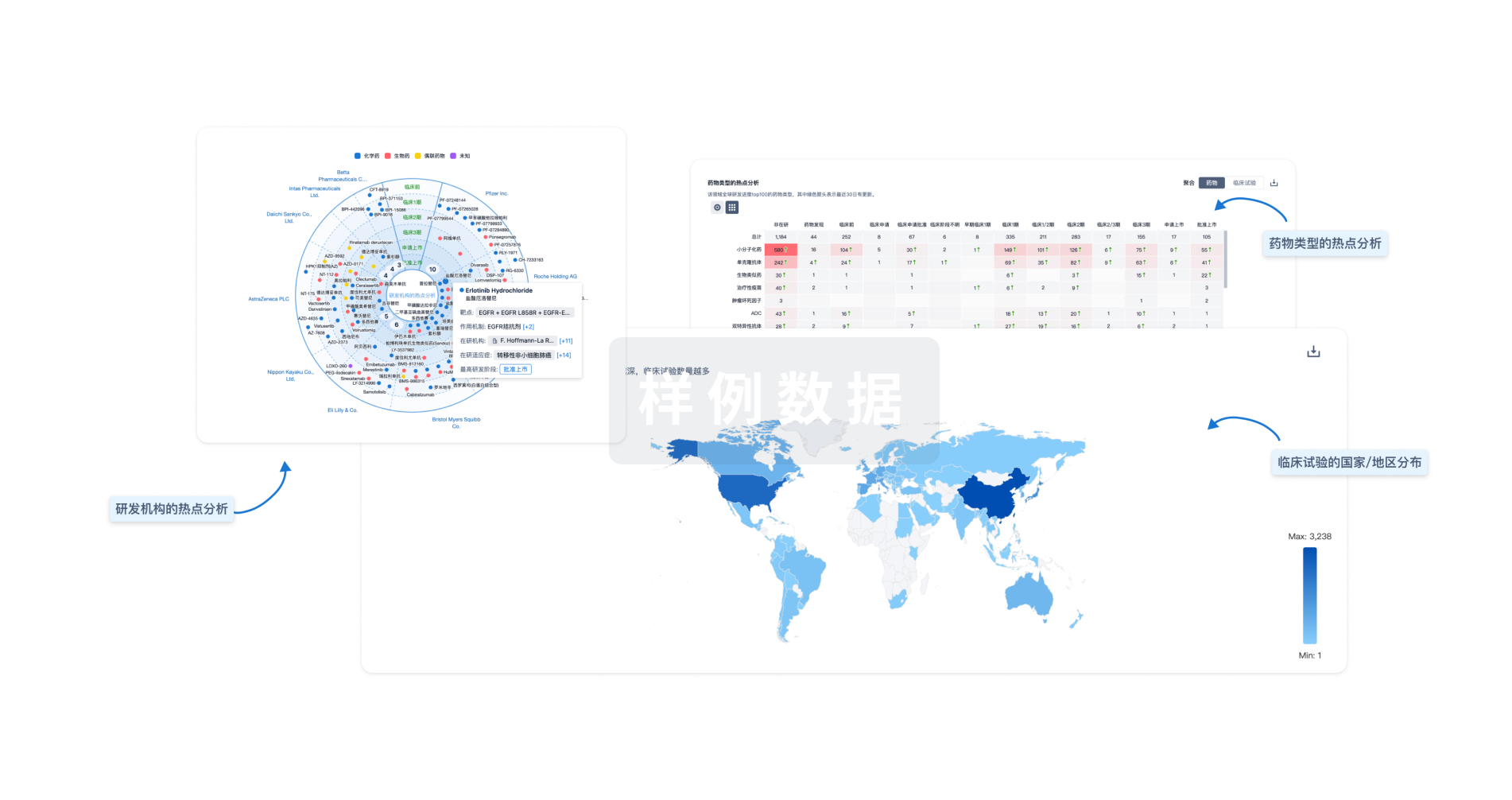
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用