预约演示
近十年首款!肝病“first-in-class"小分子获FDA批准!
优先审批突破性疗法加速审批临床结果
益普生(Ipsen)今天宣布,美国FDA已加速批准Iqirvo(elafibranor)80毫克片剂与熊去氧胆酸(UDCA)联合用于治疗对UDCA应答不足的成人原发性胆汁性胆管炎(PBC),或作为单药疗法治疗对UDCA不耐受的患者。根据新闻稿,Iqirvo是近十年来首个获批用于治疗罕见肝病原发性胆汁性胆管炎的新药。益普生已向欧洲药品管理局(EMA)和英国药品和健康产品管理局(MHRA)提交监管申请,预计两者将在2024年下半年作出最终监管决定。

Preview
来源: 药明康德
该疗法的获批主要基于关键性3期试验ELATIVE的积极结果。分析显示,主要复合终点达到显著治疗获益。分析显示,80 mg elafibranor组(51%)达到生化应答的患者与安慰剂组(4%)相比的差异为47%(P<0.001)。在试验中,生化应答定义为第52周时碱性磷酸酶(ALP)<1.67×正常值上限(ULN),ALP降低≥15%,总胆红素(TB)≤ULN。ALP和胆红素是PBC疾病进展的重要预测因素。两者水平降低可能显示胆汁淤积性损伤减轻,肝功能改善。
Preview
来源: 药明康德
此外,只有接受elafibranor治疗的患者在第52周达到ALP正常值,包含15%药物组患者(P=0.002),这是试验的一个关键次要终点。Elafibranor显著的生化效应亦显示于患者ALP水平较基线快速降低。Elafibranor组患者早在第4周就可观察到ALP水平下降,并持续至第52周,与安慰剂组相比,elafibranor组的ALP降低幅度达41%。
Elafibranor的耐受性良好,所显示的安全性特征与既往试验一致。
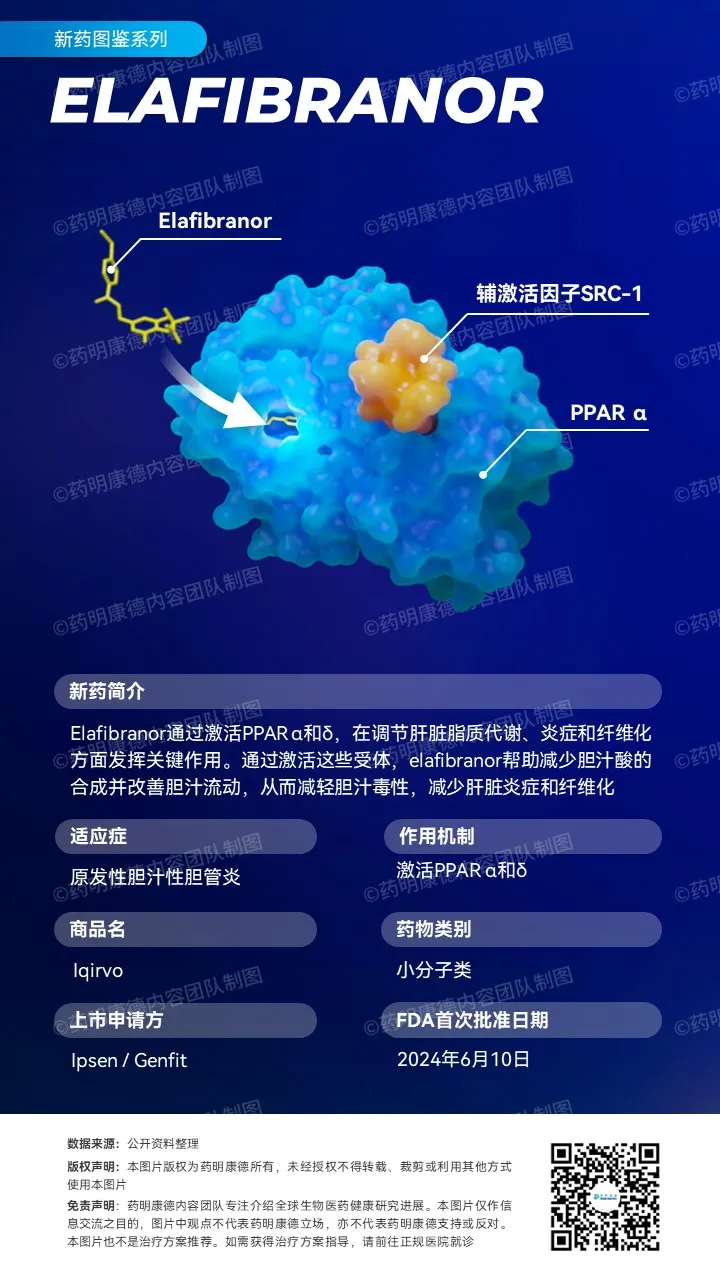
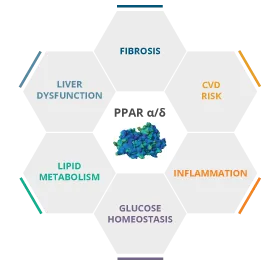
Elafibranor是一种每日一次、口服、“first-in-class"双重过氧化物酶体激活受体(PPAR)α/δ激动剂,目前正在研究用于治疗罕见自身免疫性PBC患者。同时靶向活化PPAR α/δ可潜在治疗PBC的炎症、胆汁淤积和纤维化。2019年,美国FDA授予elafibranor突破性疗法认定,用于治疗对UDCA应答不佳的PBC成人患者。
Preview
来源: 药明康德
除了elafibranor,目前开发用以治疗PBC的疗法还有吉利德科学(Gilead Sciences)的在研疗法seladelpar。这个月初所公布的3期研究分析显示,接受seladelpar治疗的中度至重度PBC成人患者中,患者报告的瘙痒迅速且持久地减少。针对代偿性肝硬化受试者的亚群分析表明,这类患者的胆汁淤积和肝损伤标志物有临床意义的改善。美国FDA已接受seladelpar用于治疗PBC患者的新药申请并授予其优先审评资格,其中包含用于治疗瘙痒症状以及那些对UDCA应答不足或不耐受的非肝硬化或代偿性肝硬化的成人患者。FDA预计将于2024年8月14日前公布审评结果。
参考资料:
[1] Ipsen’s Iqirvo® receives U.S. FDA accelerated approval as a first-in-class PPAR treatment for primary biliary cholangitis. Retrieved June 10, 2024 from https://www.globenewswire.com/news-release/2024/06/10/2896408/0/en/Ipsen-s-Iqirvo-receives-U-S-FDA-accelerated-approval-as-a-first-in-class-PPAR-treatment-for-primary-biliary-cholangitis.html
内容来源于网络,如有侵权,请联系删除。
<br>
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。




