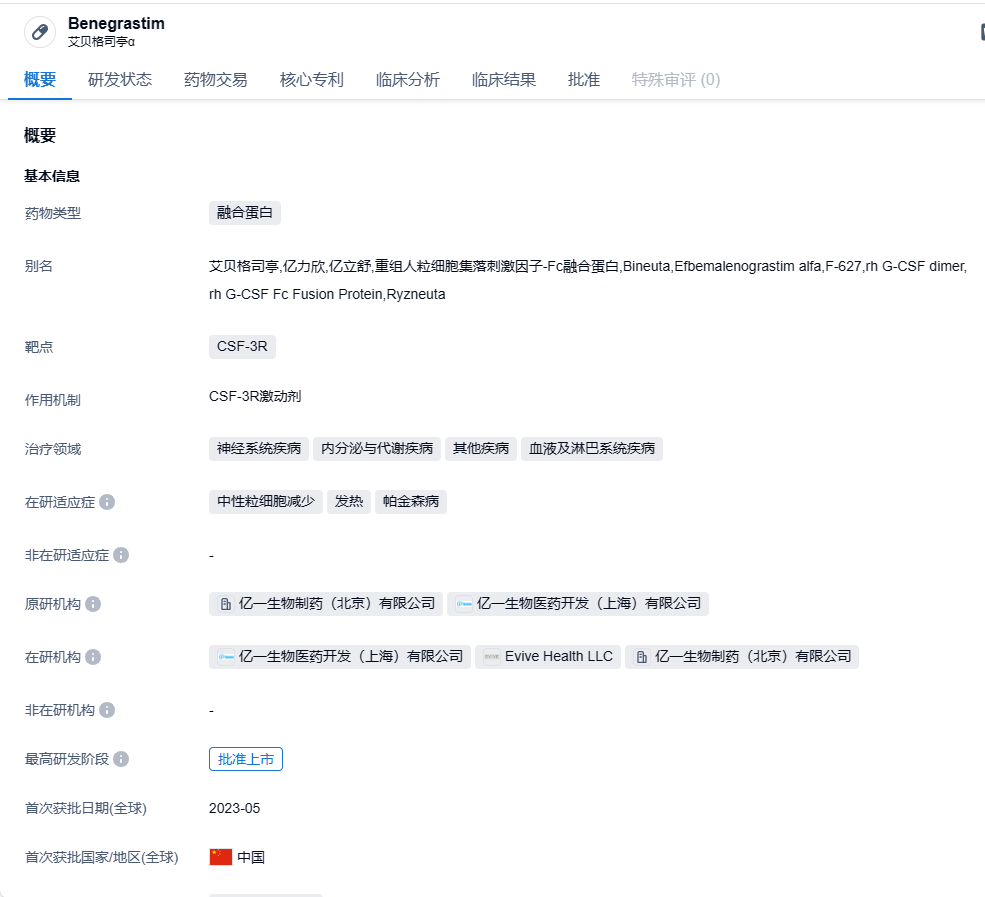
亿帆医药宣布重组融合蛋白艾贝格司亭α在美国获批上市,治疗中性粒细胞减少症
2023年11月17日,亿帆医药发布公告称,其控股子公司亿一生物(Evive Biotech)研发的艾贝格司亭α注射液(研发代码:F-627)获得美国FDA批准,用于成年非髓性恶性肿瘤患者在接受容易引起发热性中性粒细胞减少症的骨髓抑制性抗癌药物治疗时,降低以发热性中性粒细胞减少症为表现的感染发生率。
艾贝格司亭α是基于亿一生物具有自主知识产权 Di-KineTM 双分子技术平台开发的创新生物药品种;基于 Fc 融合蛋白技术,是由 CHO 细胞表达的 rhG-CSF 的二聚体。艾贝格司亭α是第三代长效升白药物,也是全球首个双分子G-CSF-Fc融合蛋白,靶向CSF-3R,具有高稳定性、低免疫原性的显著优势。2023年5月,该药物获NMPA批准上市。此前,亿一生物曾与正大天晴药业南京顺欣制药签订合作协议;根据协议条款,亿一生物将F-627的中国商业化权益独家授权给正大天晴南京顺欣,并将获得最高可达2.1亿元的首付款与里程碑付款,以及分级的净销售额提成费。
2018年1月,亿一生物完成了艾贝格司亭α注射液首个在美国及欧洲开展的3期临床试验(简称“04试验”),并达到预设主要疗效终点,受试者耐受情况良好,安全性达到预期。2020年1月,亿一生物收到在中国开展的艾贝格司亭α注射液的3期临床试验《统计数据图表合集》,统计结果表明,该产品中国3期临床试验的有效性结果已全面达到临床试验预设评价标准,疗效与对照药品(原研药品重组人粒细胞集落刺激因子)相当。
2020年6月,亿一生物收到在美国及欧洲开展的第二个国际3期临床试验(简称“05试验”)《统计数据图表合集》,结果显示,第二个国际3期临床试验成功达到预设主要疗效终点和次要疗效终点,药物疗效与对照药品相当;2020年7月,公司完成了05试验有关免疫原性的中和抗体检测,结果为阴性,标志着无药物相关的抗体产生;自此,艾贝格司亭α注射液海内外开展的1~3临床试验均达到临床试验预设目标。2021年3月,亿一生物就艾贝格司亭α注射液向FDA提交了生物制品许可申请。
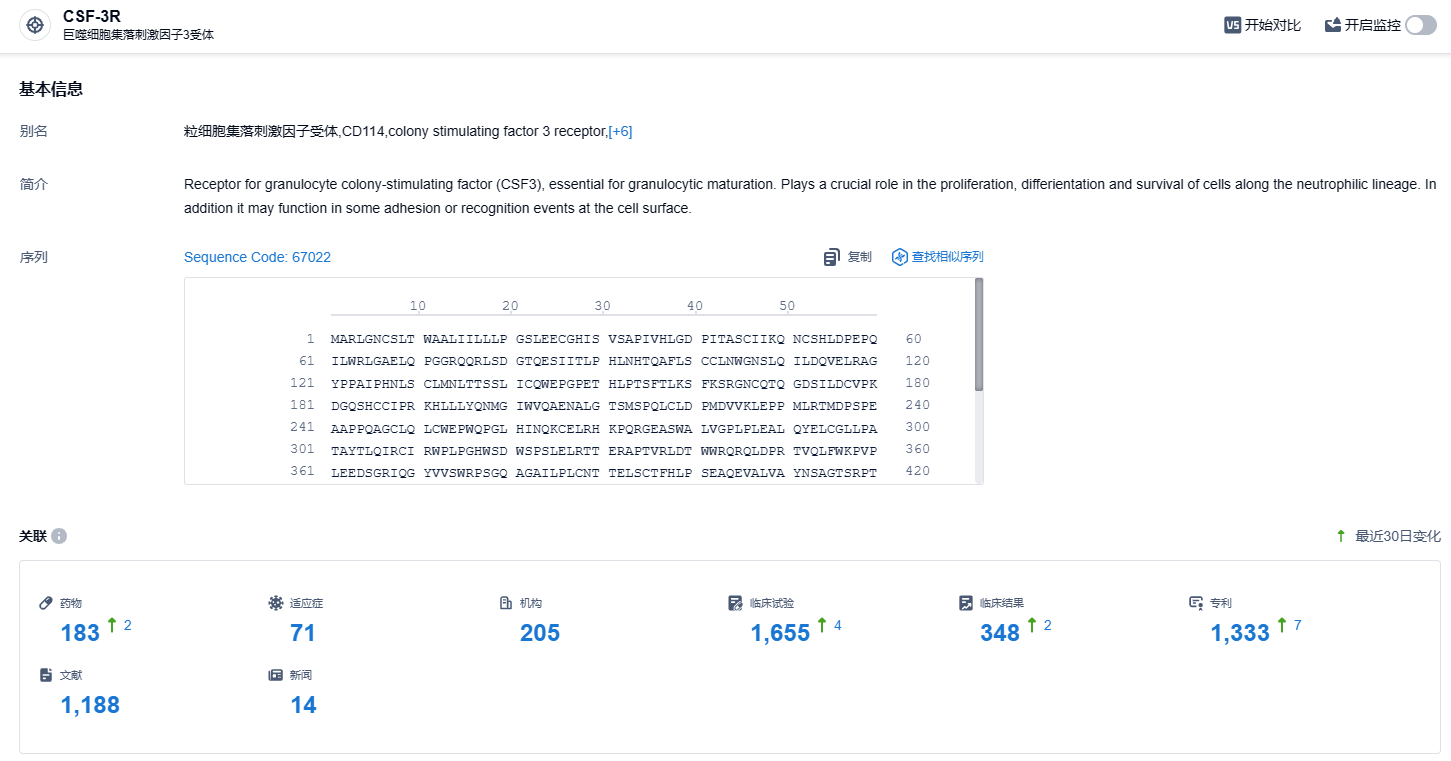
根据智慧芽新药情报库所披露的信息 (点击下方图片直达CSF-3R靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月18日,CSF-3R靶点共有在研药物183个,包含的适应症有71种,在研机构205家,涉及相关的临床试验1655件,专利多达1333件……CSF包括短效和长效两种类型,其中短效G-CSF在每个化疗周期内需要每日给药1~2次,如安进的Nupogen(非格司亭)、中外株式会社的Lenograstim(来格司亭),长效G-CSF主要通过聚乙二醇修饰来制备,在一个化疗周期中往往只需给药1次,如安进的Neulasta(培非格司亭,糖基化修饰)、恒瑞医药的艾多(硫培非格司亭)。期待艾贝格司亭α能够在美国商业化顺利,展现国产创新药风采。