Anavex口服SIGMAR1激活剂blarcamesine阿尔茨海默病疗法递交上市申请
近日,Anavex Life Sciences宣布,已向欧洲药品管理局(EMA)提交了在研疗法blarcamesine的上市许可申请(MAA),用于治疗阿尔茨海默病。这是blarcamesine在全球范围内的首个上市申请。
Blarcamesine是一款每日口服一次的小分子SIGMAR1(σ1 receptor)激活剂。blarcamesine的优势在于它是一种口服小分子药物,对认知能力和神经退行性病变有临床疗效。SIGMAR1是一种整合膜蛋白,可激活上游代偿过程。Blarcamesine通过激活SIGMAR1诱导自噬,从而恢复细胞稳态。与携带SIGMAR1突变(变异体)的患者相比,携带未突变的常见SIGMAR1野生型(WT)1基因的患者预计对blarcamesine产生更强的有益应答,不过后者也从治疗中获益。
在一项为期48周的2b/3期临床研究中,该药物在主要终点——评估认知能力的ADAS-Cog13评分上表现出具有临床意义的改善。根据主要终点ADAS-Cog13评分,blarcamesine将患者疾病进展显著减缓了36.3%。在SIGMAR1野生型患者组中,48周时,blarcamesine将疾病进展减缓了49.8%。
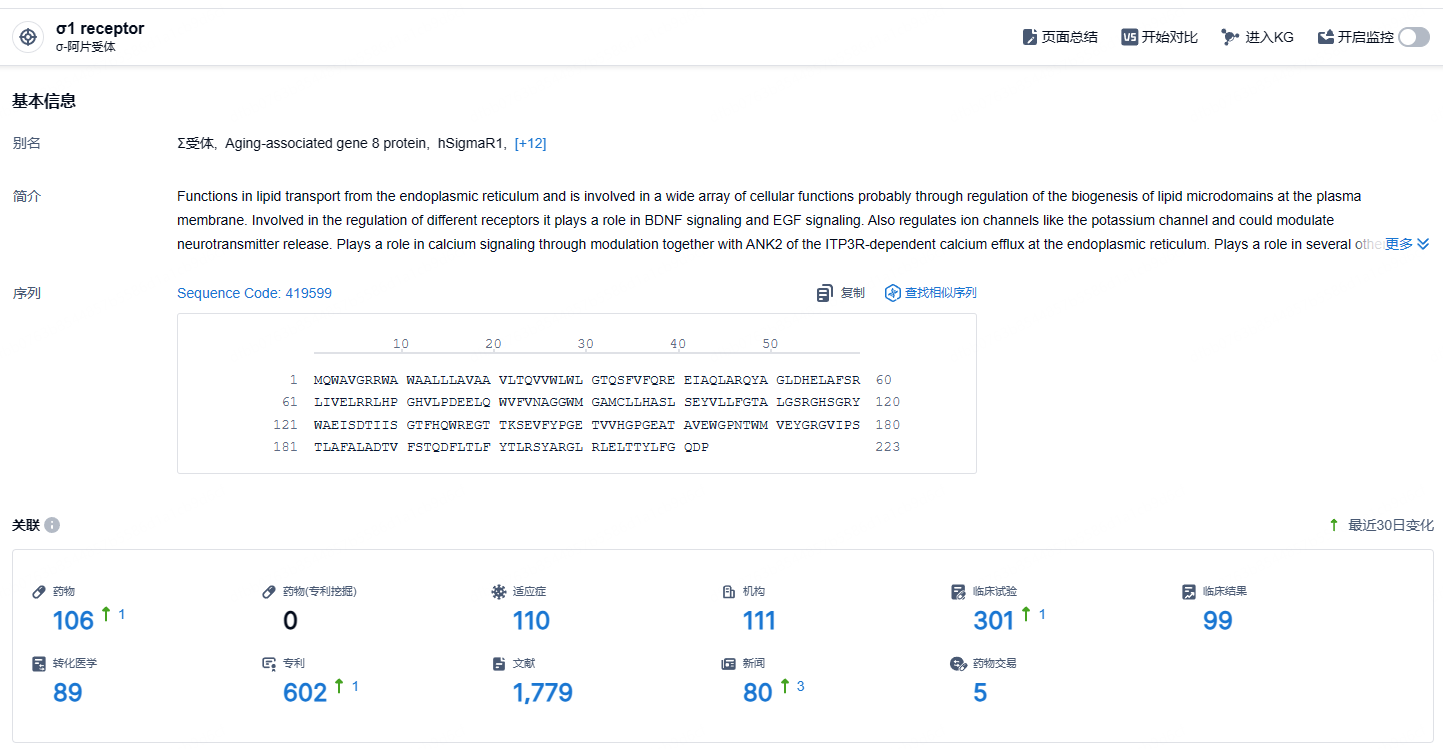
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达σ1 receptor靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年11月30日,σ1 receptor靶点共有在研药物108个,包含的适应症有110种,在研机构111家,涉及相关的临床试验301件,专利多达602件……每天口服一次的小分子药物Blarcamesine在48周内显示出了有临床意义的改善,主要终点ADAS-Cog13评分大于2分。Blarcamesine的安全性表明它不需要常规的核磁共振成像监测,鉴于其作用机制的差异,它可能是一种新型治疗方法,可以补充或替代抗β淀粉样蛋白单克隆抗体药物。期待该药早日获批。