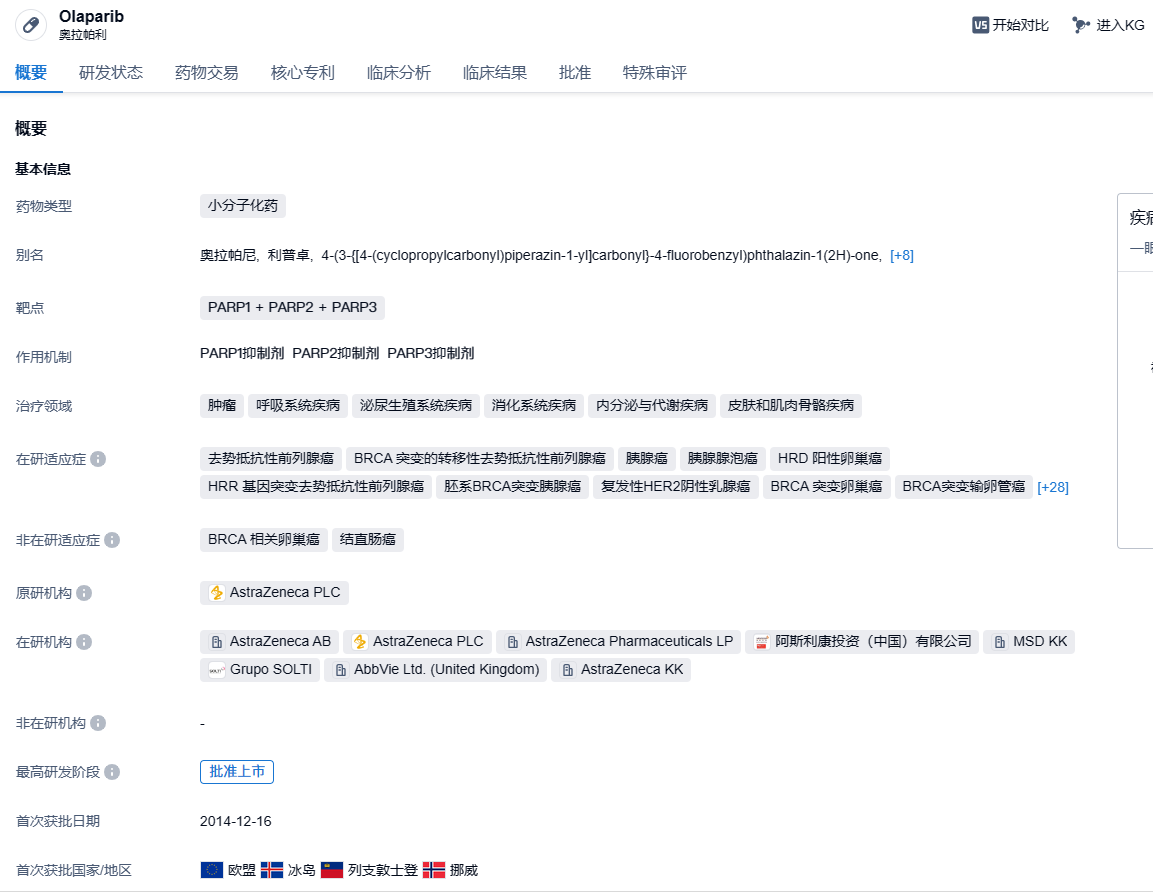
阿斯利康PARP抑制剂奥拉帕利在华申报新适应症,针对乳腺癌
2024年1月9日,中国国家药监局药品审评中心(CDE)官网公示,阿斯利康的奥拉帕利片的一项新适应症上市申请已获得受理,本次其申报上市的适应症为:奥拉帕利单药或与内分泌治疗联合用于既往接受过新辅助或辅助化疗的胚系BRCA1/2突变的HER2阴性早期高危乳腺癌成人患者的辅助治疗。
奥拉帕利(olaparib,英文商品名Lynparza)是阿斯利康和默沙东(MSD)联合开发的一款“first-in-class”新药,可靶向抑制DNA损伤修复酶(PARP)。通过靶向DNA损伤修复反应(DDR)通路,奥拉帕利能够利用“合成致死”原理,在杀伤癌细胞的同时,不影响健康细胞。“合成致死”是指两个非致死基因同时被抑制,导致细胞死亡的现象。在中国,奥拉帕利于2018年8月首次获批上市,用于铂敏感复发性卵巢癌患者的维持治疗。此后该产品陆续在中国获批多个适应症,包括BRCA突变晚期卵巢癌一线维持治疗、携带胚系或体细胞BRCA突变且既往治疗失败的转移性去势抵抗性前列腺癌成人患者的治疗、与贝伐珠单抗联合用于HRD阳性晚期卵巢癌一线维持治疗。
针对该适应症,阿斯利康和默沙东已经于2022年3月公布了3期OlympiA试验的进一步阳性结果,并在欧洲肿瘤内科学会(ESMO)线上全体会议上公布。该研究旨在比较奥拉帕利片剂与安慰剂作为辅助治疗对胚系BRCA突变 (gBRCAm) 高危HER2阴性早期乳腺癌患者的疗效和安全性,这些患者已完成根治性局部治疗和新辅助或辅助化疗。研究结果显示,在总生存期(OS)的关键次要终点中,与安慰剂相比,奥拉帕利将死亡风险降低了32%。奥拉帕利将三年生存率提高到92.8%,而安慰剂组为89.1%。接受奥拉帕利治疗的患者中,有89.8%的患者存活四年,而安慰剂组中为86.4%。本试验中奥拉帕利的安全性和耐受性与先前临床试验中观察到的一致。基于该研究结果,奥拉帕利已于2022年3月获美国FDA批准,作为辅助疗法治疗已在手术前或手术后接受过化疗的gBRCAm HER2阴性高危早期乳腺癌患者。
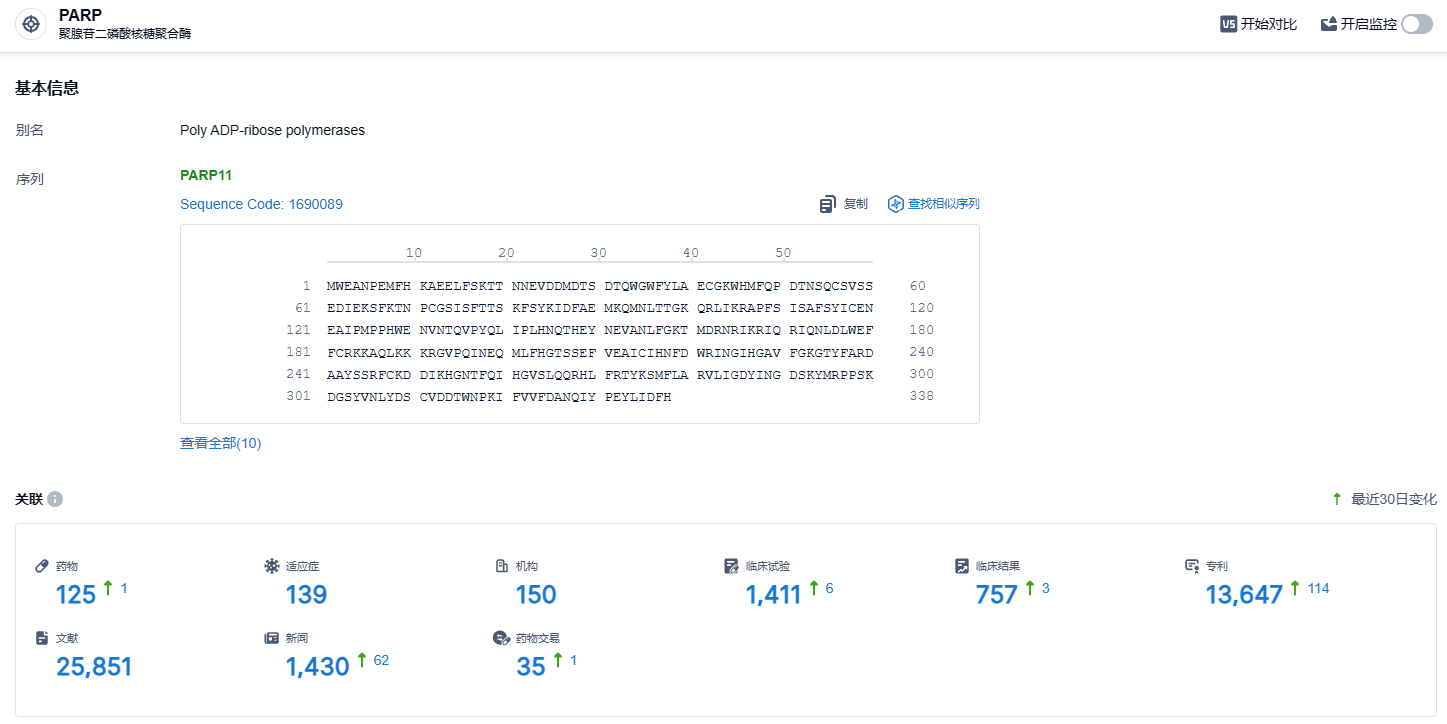
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PARP 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年1月10日,PARP 靶点共有在研药物125个,包含的适应症有139种,在研机构150家,涉及相关的临床试验1411件,专利多达13647件……希望此次奥拉帕利新适应症早日获批,能够为乳腺癌患者带来更多新的治疗选择。