2023年AAO年会 | 信达生物公布2款双靶点眼科新药IBI302和IBI324最新临床数据
2023年11月6日,信达生物发布新闻稿称,在2023年美国眼科学会(AAO)年会上公布了两项最新临床研究结果,分别为抗VEGF-抗补体双靶点药物(IBI302)治疗新生血管性年龄相关性黄斑变性(nAMD)的临床2期数据,以及抗VEGF-A/Ang-2双特异性抗体(IBI324)治疗糖尿病性黄斑水肿(DME)的临床1期数据。
IBI302是信达生物拥有全球知识产权的一种双特异性重组全人源融合蛋白,靶点为C3b + C4B + Complement receptors + VEGF。N端为VEGF结合域,能够与VEGF家族结合阻断VEGF介导的信号通路,抑制血管内皮细胞的生存、增殖,从而抑制血管新生,降低血管渗透性,减少血管渗漏;C端为补体结合域,能够通过特异性结合C3b和C4b,抑制补体经典途径和旁路途经的激活,减轻补体活化介导的炎症反应。IBI302潜在通过同时抑制VEGF介导的新生血管生成和补体活化通路,发挥治疗作用。
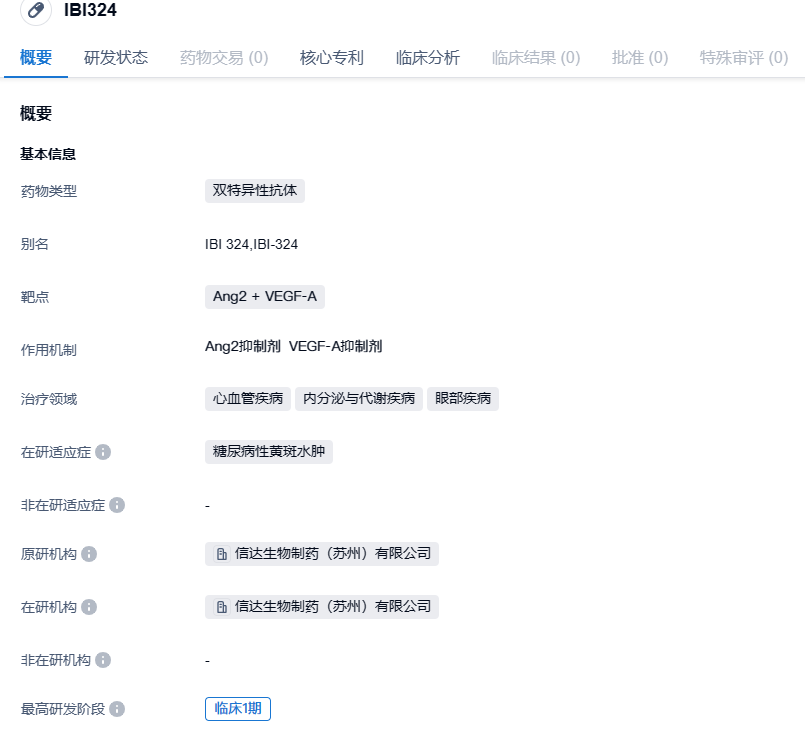
IBI324是信达生物自主研发的抗Ang2 + VEGF-A双靶点特异性重组全人源化抗体:N端能够阻断VEGF-A介导的信号通路,抑制血管内皮细胞的生存、增殖,从而抑制血管新生,减少新生血管渗漏;C端为Ang-2结合域,为信达自主筛选获得的抗Ang-2,不结合Ang-1,抑制Ang-2与Tie-2受体结合,改善对其他炎症因子的敏感性,进一步稳定血管,抑制血管渗漏。IBI324同时阻断VEGF-A和Ang-2的双重机制,可能为DME患者带来更多临床获益。
①本次在大会上公布的是IBI302治疗新生血管性年龄相关性黄斑变性(nAMD)的2期研究最新结果。该试验旨在评估IBI302治疗nAMD的疗效和安全性,231例nAMD受试者按1:1:1随机接受2mg IBI302、4mg IBI302或2mg阿柏西普治疗(3针每四周一次的负荷治疗,之后每8周间隔给药,整个试验持续至52周)。研究的主要终点为36周时研究眼最佳矫正视力(BCVA)较基线的改变。研究结果显示,第36周时IBI302 2mg/4mg组BCVA改善情况非劣于阿柏西普2mg组。第36周时IBI302 2mg组、IBI302 4mg组、阿柏西普 2mg组BCVA较基线变化均值分别为+10.6、+11.4和+12.0个字母。各组间光学相干断层扫描(OCT)测量的视网膜中央厚度(CST)改善情况相当。观察到IBI302预防黄斑萎缩和纤维化发生的初步信号。第52周时IBI302 2mg组、IBI302 4mg组、阿柏西普2mg组OCT上黄斑萎缩的发生率分别为5.2%、5.2%、9.1%;彩色眼底照相上纤维化的发生率分别为16.9%、11.7%、14.3%。安全性方面,IBI302 2mg组、IBI302 4mg组、阿柏西普2mg组安全性相当。IBI302组无眼内炎或视网膜血管炎发生。
②本次在大会上公布的是IBI324治疗糖尿病性黄斑水肿(DME)的1期研究最新结果。该研究旨在评估IBI324治疗DME的安全性、耐受性及有效性,研究分为两个阶段,单次给药(SAD)阶段和多次给药(MAD)阶段。研究结果显示,安全性方面,4mg/眼为研究中最大耐受剂量。研究期间未发生眼部严重不良事件、眼内炎症及剂量限制性毒性。SAD阶段,至给药后第42天,IBI324各剂量组BCVA和CST均较基线有所改善。MAD阶段,至第三次给药后4周(第84天),IBI324 2mg和4mg组BCVA较基线分别改善6.7±5.4和7.7±4.7个字母。
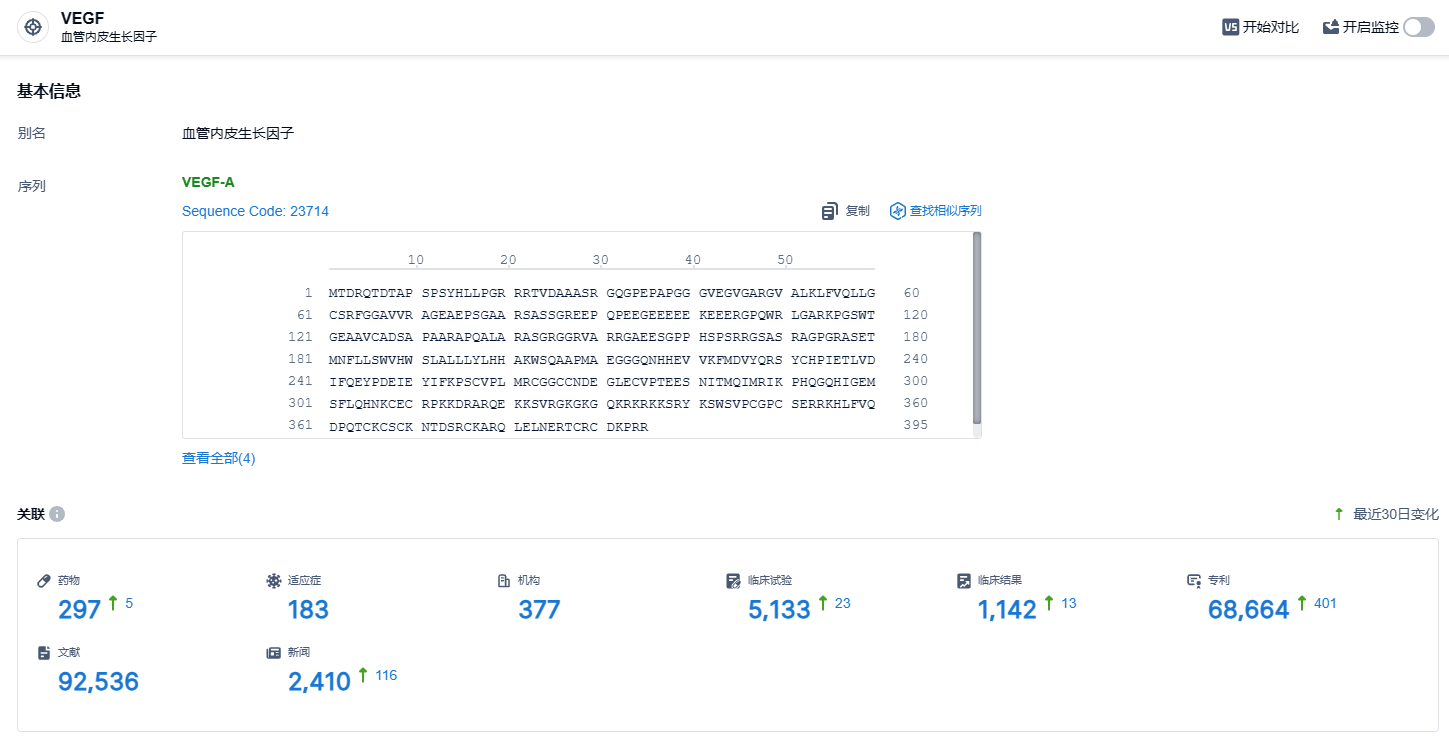
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 VEGF 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月7日,VEGF靶点共有在研药物297个,包含的适应症有183种,在研机构377家,涉及相关的临床试验5133件,专利多达68664件……在抗VEGF的基础上开发多靶点药物是目前眼底病药物研发的趋势。信达生物两款眼科产品IBI302和IBI324分别在nAMD和DME患者中展现出良好的疗效,未识别新的安全性风险信号。期待通过多靶点药物的探索,早日为广大眼底疾病患者的临床治疗带来更多选择。