第一三共/阿斯利康德曲妥珠单抗新适应症拟纳入优先审评,治疗HER2阳性胃癌
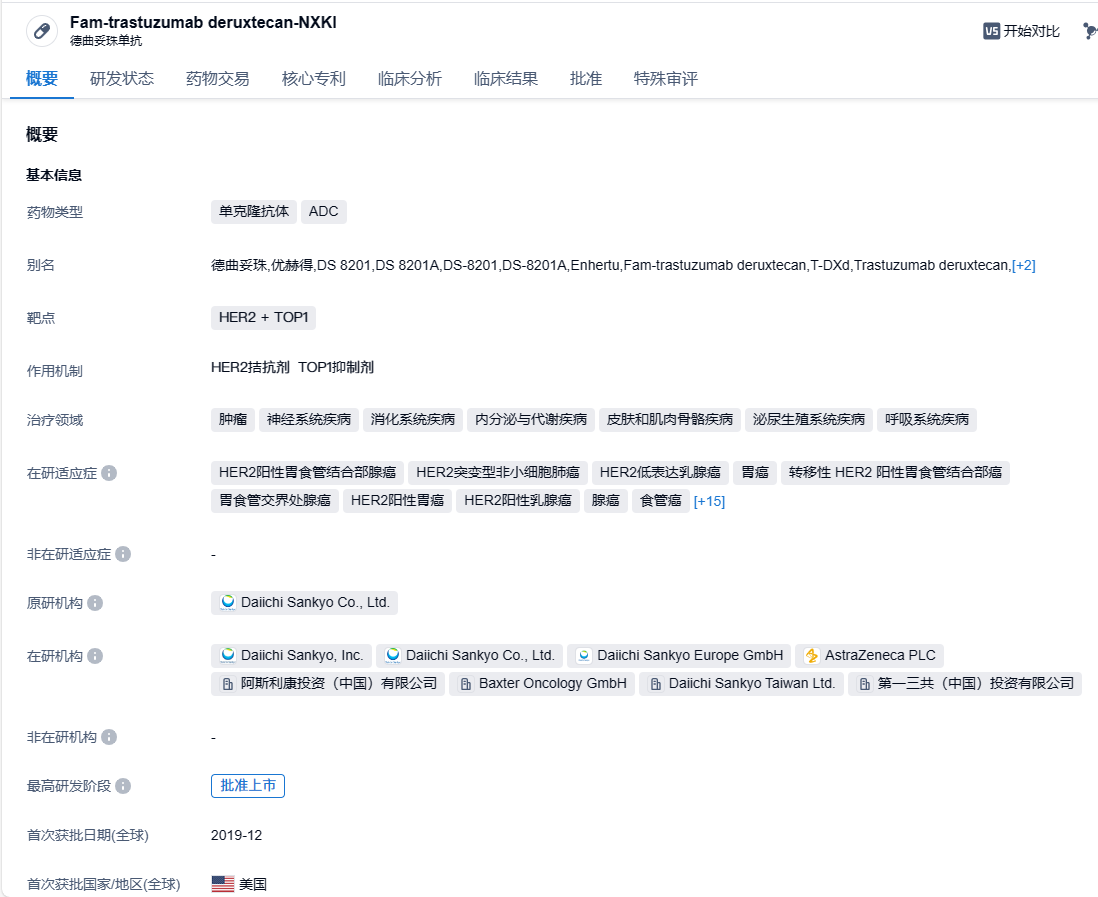
2023年11月6日,CDE官网显示,第一三共/阿斯利康的德曲妥珠单抗(Enhertu,T-DXd)新适应症上市申请拟纳入优先审评,单药适用于治疗既往接受过两种或两种以上治疗方案的局部晚期或转移性HER2阳性成人胃或胃食管结合部(GEJ)腺癌患者。
德曲妥珠单抗(Trastuzumab deruxtecan)(研发代号:DS-8201)由抗HER2人源化单克隆抗体与载药拓扑异构酶Ⅰ抑制剂DXd(payload)通过可裂解连接子(linker)组成,其DAR值达理论最大值8,具有避免耐药、特异性强、高细胞毒性和安全性良好的特点。与HER2结合后,德曲妥珠单抗会破坏HER2信号,介导抗体依赖的细胞毒性反应,并通过内吞进入细胞内释放DXd,进而导致DNA损伤和细胞凋亡。此外,连接子与载药连接处的自切割修饰赋予的高效膜透过性,使德曲妥珠单抗能够发挥“旁观者效应”,克服瘤内异质性。本品最早由第一三共开发。2019年3月,阿斯利康与第一三共达成一项高达69亿美元的合作,在全球范围内共同开发和商业推广德曲妥珠单抗。2023年2月,注射用德曲妥珠单抗获得NMPA批准上市,单药适用于治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者。
在DESTINY-Gastric01研究中,经曲妥珠单抗治疗后进展的HER2阳性晚期三线及以上胃癌患者,接受T-DXd治疗后中位OS长达12.5个月,相比化疗组(8.4个月)显著延长,12个月OS率分别为52.1%和28.9%;T-DXd治疗组ORR为51.3%,是化疗组(14.3%)的3倍多。经确认的ORR分别为42.9%和12.5%,DCR为 85.7% 和 62.5%,mDOR分别为11.3和3.9个月,mPFS分别为5.6和3.5个月。基于DESTINY-Gastric01研究和/或DESTINY-Gastric02研究结果,德曲妥珠单抗已在30多个国家/地区获批用于治疗既往接受过基于曲妥珠单抗的治疗方案的局部晚期或转移性HER2阳性胃或胃食管交界处(GEJ)腺癌成人患者。
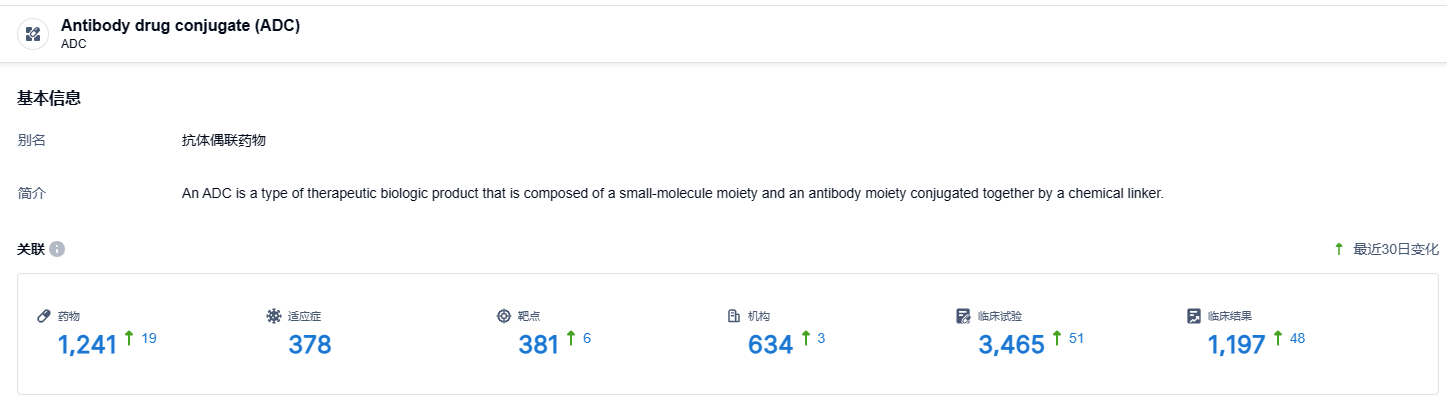
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 ADC 药物类型注册登录后可免费获得该药物类型下的在研药物、适应症、靶点、研发机构、临床试验等详细信息),截止到 2023 年11月7日,ADC这一药物类型共有在研药物1241个,包含的适应症有378种,靶点381个,在研机构634家,涉及相关的临床试验3465件……ADC药物研发已成红海之势,而HER2更是布局更多的靶点之一。期待德曲妥珠单抗的后续表现。