优时比靶向IL-17A/IL-17F比奇珠单抗在华获批上市,针对自身免疫疾病
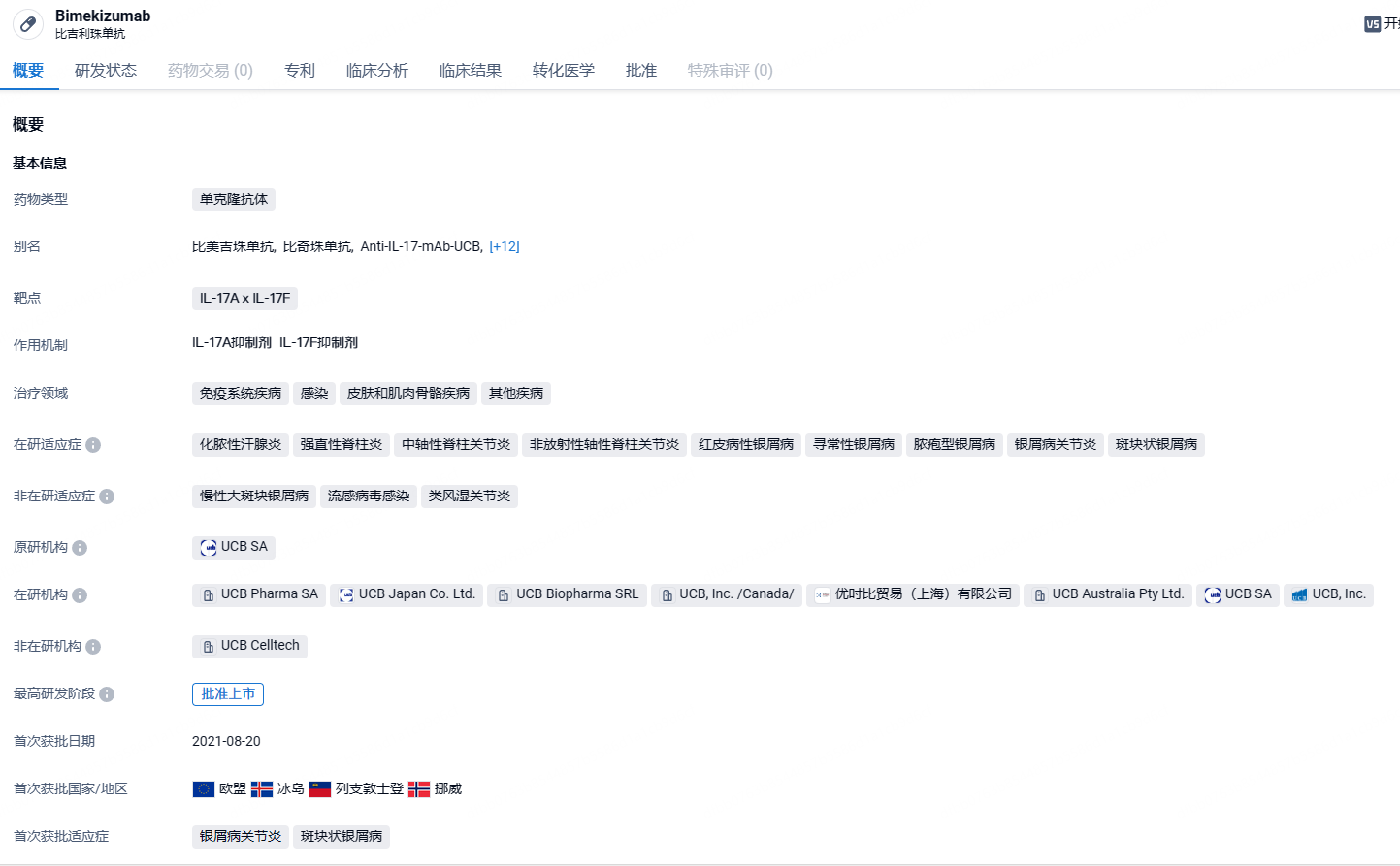
7月19日,NMPA官网公示优时比公司申报的白细胞介素17A(IL-17A)和白细胞介素17F(IL-17F)生物制剂比奇珠单抗(Bimekizumab)获批上市,用于常规治疗疗效不佳或不耐受的活动性强直性脊柱炎成人患者。这也是国内首款获批上市的IL-17A x IL-17F单抗。
比奇珠单抗(Bimekizumab)是一种人源化单克隆IgG1抗体,旨在同时抑制白细胞介素 17A(IL-17A)和白细胞介素17F(IL-17F)这两种驱动炎症过程的关键细胞因子。这种独特的作用机制相比于其他IL-17A类药物可能有更好的疗效。bimekizumab于2021年8月在欧盟和英国获批用于适合系统治疗的成人中重度斑块状银屑病,2022年1月在日本获批,用于治疗对现有疗法响应不足的成人斑块状银屑病、泛发性脓疱型银屑病、红皮病型银屑病患者。2022年2月和3月又陆续在加拿大和澳大利亚获批。2022年9月20日,UCB宣布,欧洲药品管理局(EMA)已受理bimekizumab的两项上市许可申请(MAA),用于治疗成人活动性银屑病关节炎(PsA)和活动性中轴型脊柱关节炎(axSpA)患者。2022年12月9日,优时比宣布bimekizumab针对成人中重度化脓性汗腺炎的两项III期研究(BE HEARD I和BE HEARD II)均达到主要终点。并于2024年递交上市申请。
2022年12月7-11日,UCB在亚太风湿病学会联盟(APLAR)年会上公布了bimekizumab治疗放射学阴性axSpA和活动性强直性脊柱炎(AS)的两项III期研究(BE MOBILE 1&2)数据。其中,BE MOBILE 2研究的中国AS患者亚组(N=44)数据显示,患者的ASAS40应答比例为40.7%,显著高于安慰剂组(11.8%)。因此,UCB今日在中国获批的bimekizumab的适应症可能为AS。
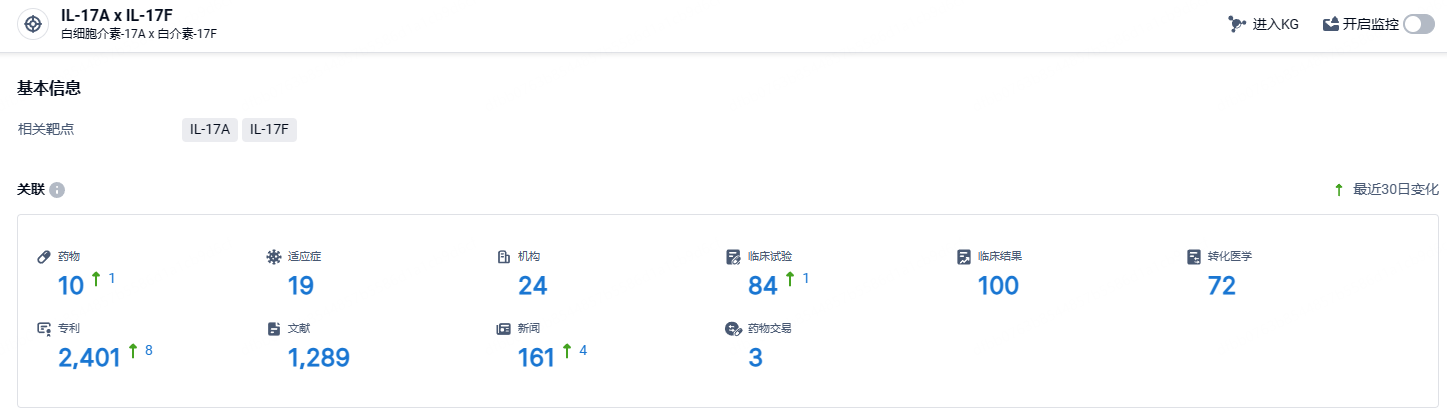
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达IL-17A x IL-17F靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年7月20日,IL-17A x IL-17F靶点共有在研药物10个,包含的适应症有19种,在研机构24家,涉及相关的临床试验84件,专利多达2401件……国内已获批的IL-17类单抗总共有3款,分别为诺华司库奇尤单抗(2019年获批)、礼来依奇珠单抗(2019年获批)以及协和麒麟布罗利尤单抗(2020获批),其中,司库奇尤单抗和依奇珠单抗为国内使用靶向IL-17药物治疗方案的主流药物。期待比奇珠单抗(Bimekizumab)的后续表现。