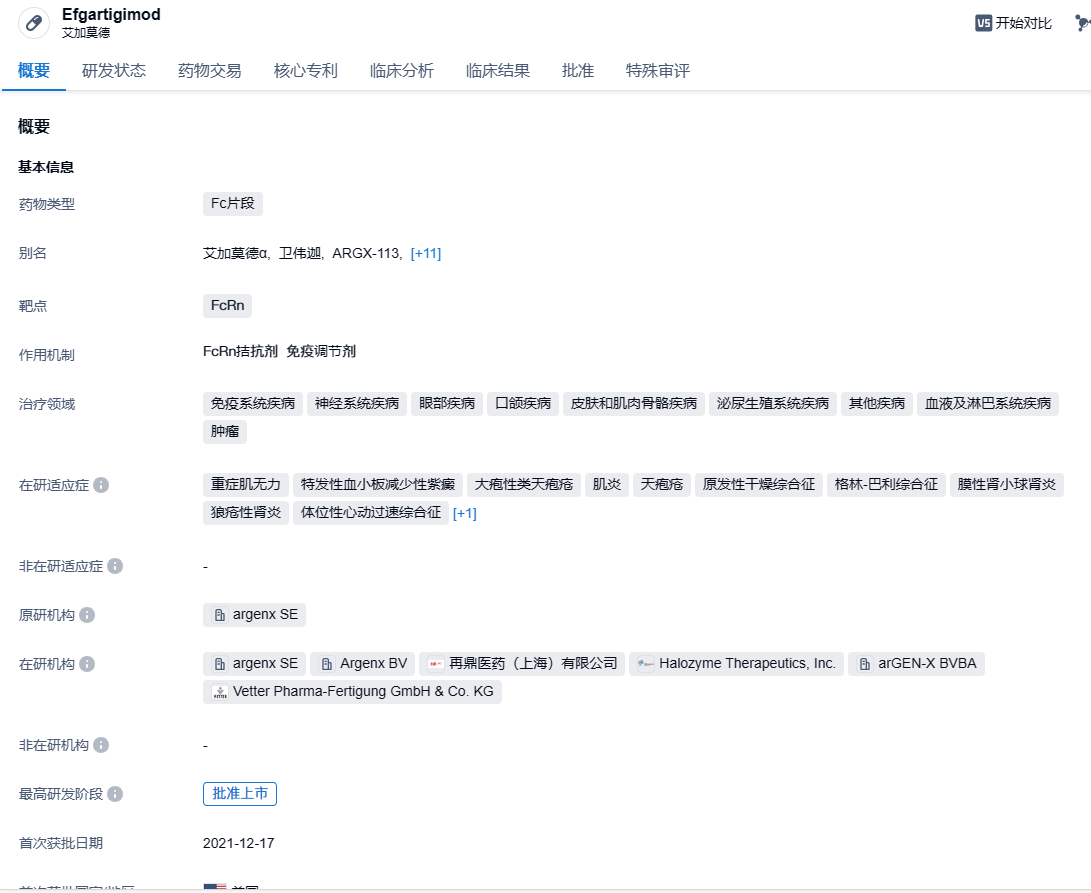
再鼎医药FcRn拮抗剂艾加莫德在国内获批,治疗全身型重症肌无力
7月16日,再鼎医药与Argenx联合宣布,国家药品监督管理局已经批准了卫力迦®(艾加莫德皮下注射,1,000mg(5.6ml)/瓶)的生物制品上市许可申请,与常规治疗药物联合,用于治疗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力(gMG)患者。
艾加莫德皮下注射剂是由人IgG1抗体的Fc片段艾加莫德α静脉输注(商品名卫伟迦®)和重组人透明质酸酶PH20(rHuPH20)共同配制,使用Halozyme的ENHANZE®药物递送技术将生物制剂通过皮下注射给药。艾加莫德皮下注射可与新生儿Fc受体(FcRn)结合,使循环IgG水平降低。艾加莫德α注射液(皮下注射)是皮下注射剂型的艾加莫德α注射液和重组人透明质酸酶PH20的中国国际非专利药品名称。其在美国以VYVGART Hytrulo的商品名上市,在其他地区获批后可能以不同的商品名上市。再鼎医药与argenx达成独家许可协议,在大中华区(中国内地、香港、澳门和台湾地区)开发和商业化艾加莫德。
艾加莫德皮下注射的获批是基于全球3期ADAPT-SC研究的阳性结果。该研究是3期临床研究ADAPT的桥接研究,此前基于ADAPT研究,艾加莫德静脉输注剂型已经获批用于治疗成人gMG患者。ADAPT-SC研究达到了非劣效性的主要研究终点,在第29天,与基线水平相比,艾加莫德皮下注射组平均总免疫球蛋白G(IgG)减少66.4%,而静脉输注剂型组为62.2%。同时,该研究也达到了其他关键次要研究终点,与3期临床研究ADAPT中总IgG减少与临床疗效获益之间的相关性结果一致。此外,艾加莫德皮下注射表现出与3期ADAPT研究一致的安全性。患者接受艾加莫德皮下注射治疗总体耐受性良好;最常见的不良事件是注射部位反应(ISRs),这在皮下注射的生物制剂中很常见。所有的ISRs都是轻度至中度,并随着时间的推移而缓解。
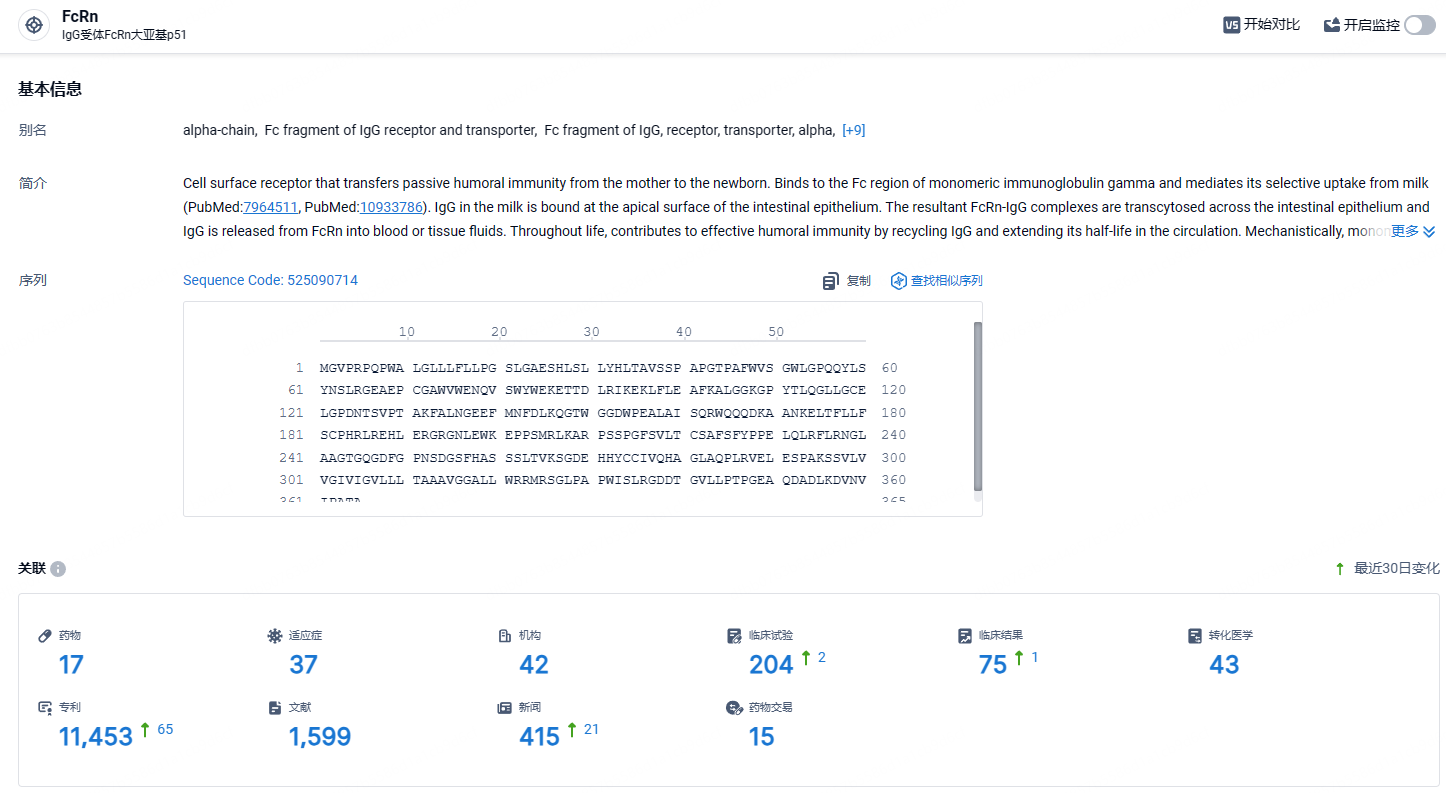
根据智慧芽新药情报库所披露的信息 (点击下方图片直达FcRn靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年7月18日,FcRn靶点共有在研药物17个,包含的适应症有37种,在研机构42家,涉及相关的临床试验204件,专利多达11453件……除了gMG,艾加莫德皮下注射也正在探索用于其他自身免疫性疾病的治疗潜力。2024年6月,美国食品药品监督管理局(FDA)批准了艾加莫德皮下注射新适应症上市,用于治疗慢性炎性脱髓鞘性多发性神经根神经病(CIDP)患者。期待艾加莫德其他适应症也能开发顺利。