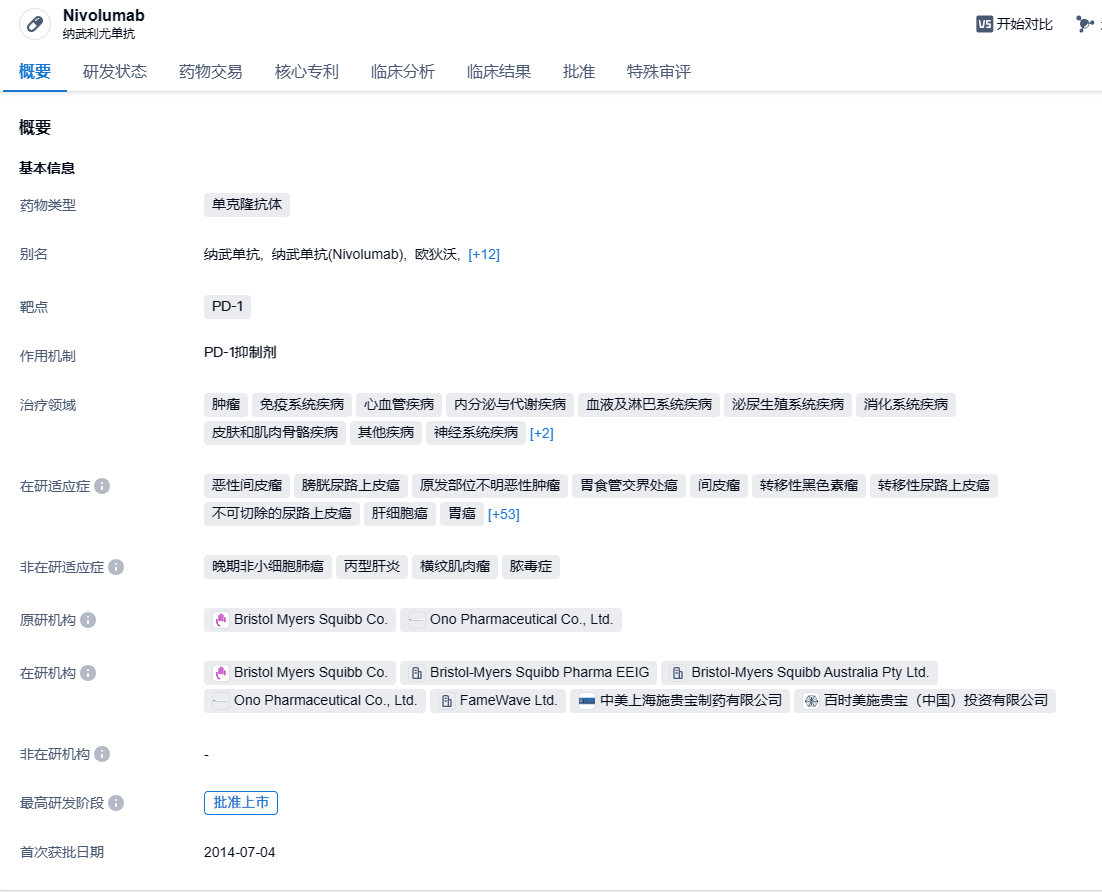
BMS重磅PD-1纳武利尤单抗组合疗法获FDA优先审评资格,一线治疗尿路上皮癌
2023年12月6日,百时美施贵宝(BristolMyersSquibb)公司宣布,美国FDA已接受重磅PD-1抑制剂Opdivo(纳武利尤单抗)联合含顺铂化疗的补充生物制品许可申请(sBLA),用于一线治疗不可切除或转移性尿路上皮癌成年患者。FDA同时授予这一申请优先审评资格,预计在2024年4月5日之前做出审评结果。
纳武利尤单抗(欧狄沃)是一种PD-1免疫检查点抑制剂,它通过与免疫细胞上的PD-1结合,阻止PD-1与PD-L1结合,进而重新激活患者自身免疫细胞来杀伤肿瘤。该药2014年12月获得美国食品和药物管理局(FDA)批准上市,2018年6月15日在中国获批上市,目前已在超过60个国家获批上市,适应症涵盖十余个癌种。2022年,该药全球销售额达到92.94亿美元,有望突破百亿美元销售门槛。
这一申请的提交得到3期临床试验CheckMate-901的支持。在这项研究中,Opdivo和含顺铂化疗的联合使用在治疗该患者群体时,与标准治疗方案相比,显示出统计上显著且具有临床意义的生存优势。在欧洲肿瘤内科学会(ESMO)大会上公布的结果显示,在中位随访期为约33个月时,Opdivo和化疗组合与单独化疗相比,将死亡风险减少了22%,Opdivo组合疗法组中位总生存期(OS)为21.7个月,对照组为18.9个月(HR=0.78;95%CI:0.63,0.96;p=0.0171)。在接受基于Opdivo的组合疗法治疗的患者中,死亡或疾病进展的风险减少了28%,与单独化疗相比,中位无进展生存期(PFS)为7.9个月比7.6个月(HR=0.72;95%CI:0.59,0.88;p=0.0012)。Opdivo与含顺铂化疗的联合使用具有可接受的安全性,与该方案组分的已知安全性一致。
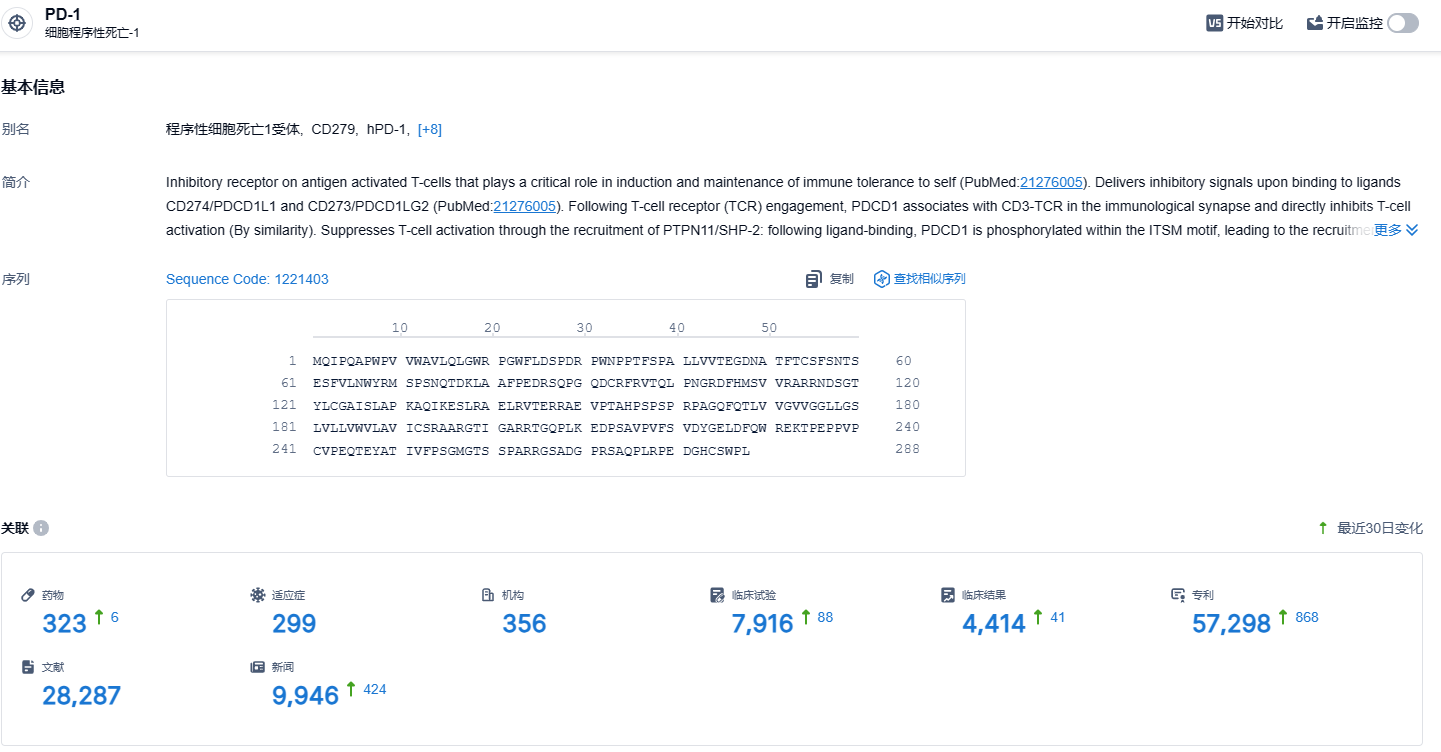
根据智慧芽新药情报库所披露的信息(点击下方卡片直达PD-1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2023年12月7日,PD-1靶点共有在研药物323个,包含的适应症有299种,在研机构356家,涉及相关的临床试验7916件,专利多达57298件……PD-1靶点是研发非常火热的领域,国内外均有众多企业布局,O药作为该领域的明星产品,期待该药的后续表现。