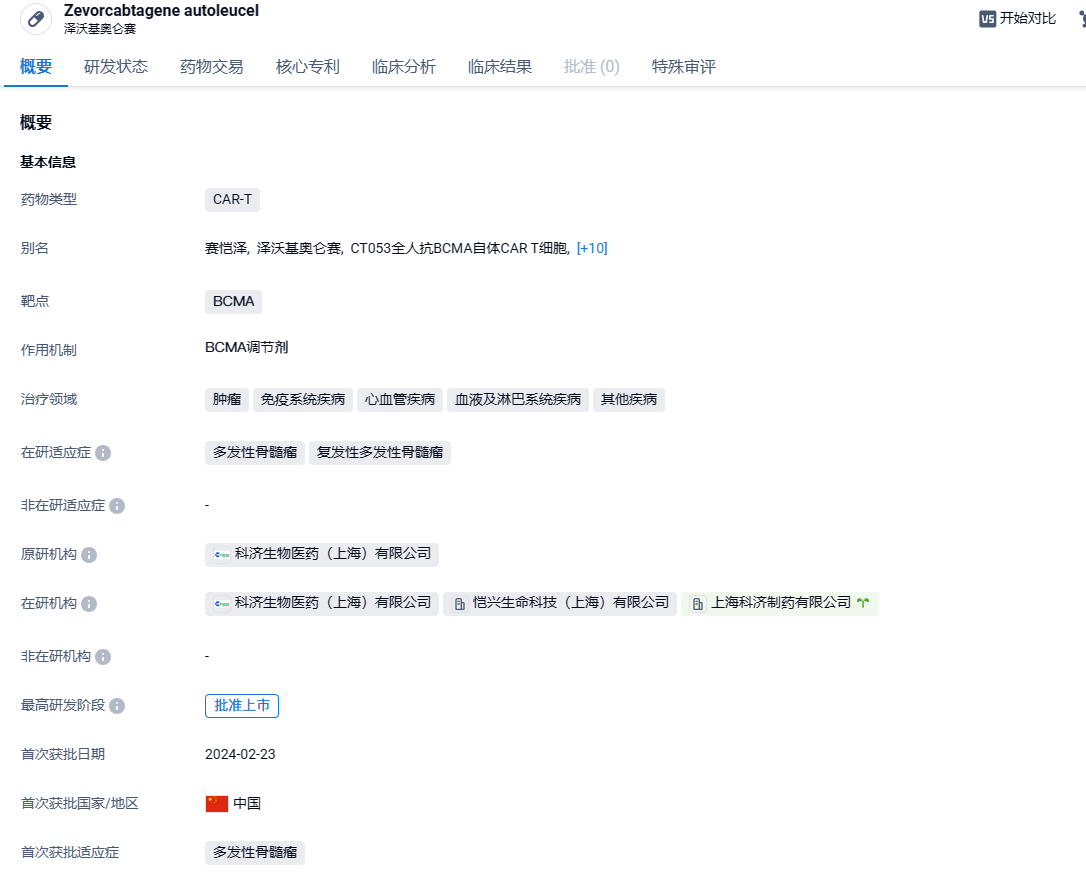
科济药业 BCMA CAR-T泽沃基奥仑赛获批上市,华东医药拥有中国大陆独家商业化权益
2024年3 月 1 日,科济药业宣布,NMPA 已正式批准赛恺泽®(泽沃基奥仑赛注射液/CT053)的新药上市申请,用于治疗复发或难治性多发性骨髓瘤成人患者,既往经过至少 3 线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。
赛恺泽®(泽沃基奥仑赛注射液/CT053)是一种自体BCMA靶向CAR-T细胞产品,它是通过慢病毒转导T细胞产生的。慢病毒编码的CAR包括全人源BCMA特异性单链可变片段(“scFv”),人CD8α铰链结构域、CD8α跨膜结构域、4-1 BB协同刺激结构域以及CD3ζ激活结构域。自研的新全人源scFv具有较高的结合亲和力和稳定性。2020 年,泽沃基奥仑赛注射液获得国家药监局的突破性治疗法认定,2022 年 10 月,其新药上市申请被 NMPA 受理,并于近日获批。2023年1月,科济药业授予华东医药赛恺泽®在中国大陆地区的独家商业化权益。根据协议条款:华东医药将支付2亿人民币的首付款,以及最高不超过10.25亿人民币的注册及销售里程碑付款;科济药业将继续负责 CT053 在中国大陆地区的开发、注册和生产。
泽沃基奥仑赛的获批是基于一项在中国进行的开放标签、单臂、多中心 I/II 期的临床试验(LUMMICAR STUDY 1,NCT03975907)。根据 2022 年美国血液学会(ASH)公布的试验结果,泽沃基奥仑赛表现出令人鼓舞的疗效和良好的安全性。结果显示,102 例患者的中位随访时间为 9 个月,ORR 为 92.2%,非常好的部分缓解(VGPR)及以上缓解的比率为 85.3%,完全缓解/严格意义完全缓解率(CR/sCR)的比率为 45.1%。
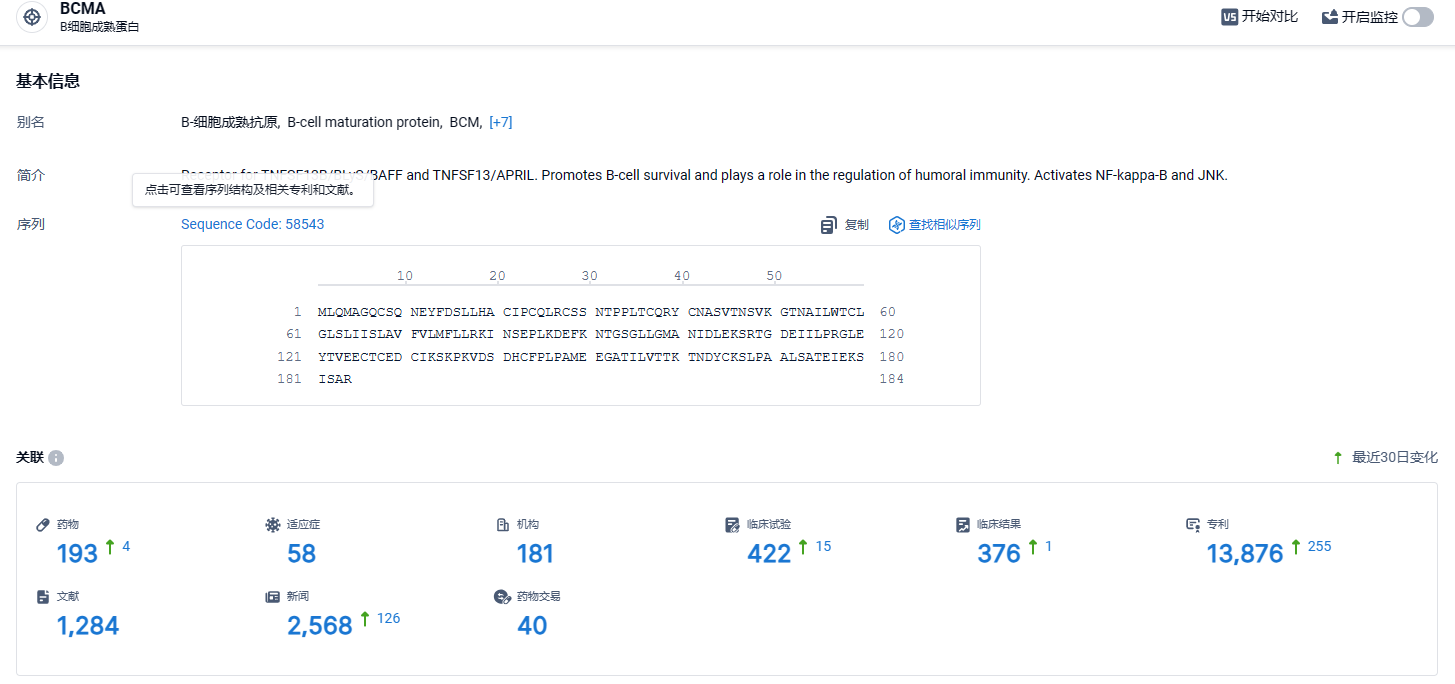
据智慧芽新药情报库所披露的信息 (点击下方图片直达 BCMA靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年3月3日,BCMA 靶点共有在研药物193个,包含的适应症有58种,在研机构181家,涉及相关的临床试验422件,专利多达13876件……泽沃基奥仑赛是继信达/驯鹿的伊基奥仑赛、复星的阿基仑赛、纳基奥仑赛、瑞基奥仑赛之后,第五款在国内获批的CAR-T产品,市场竞争变得越发激烈。