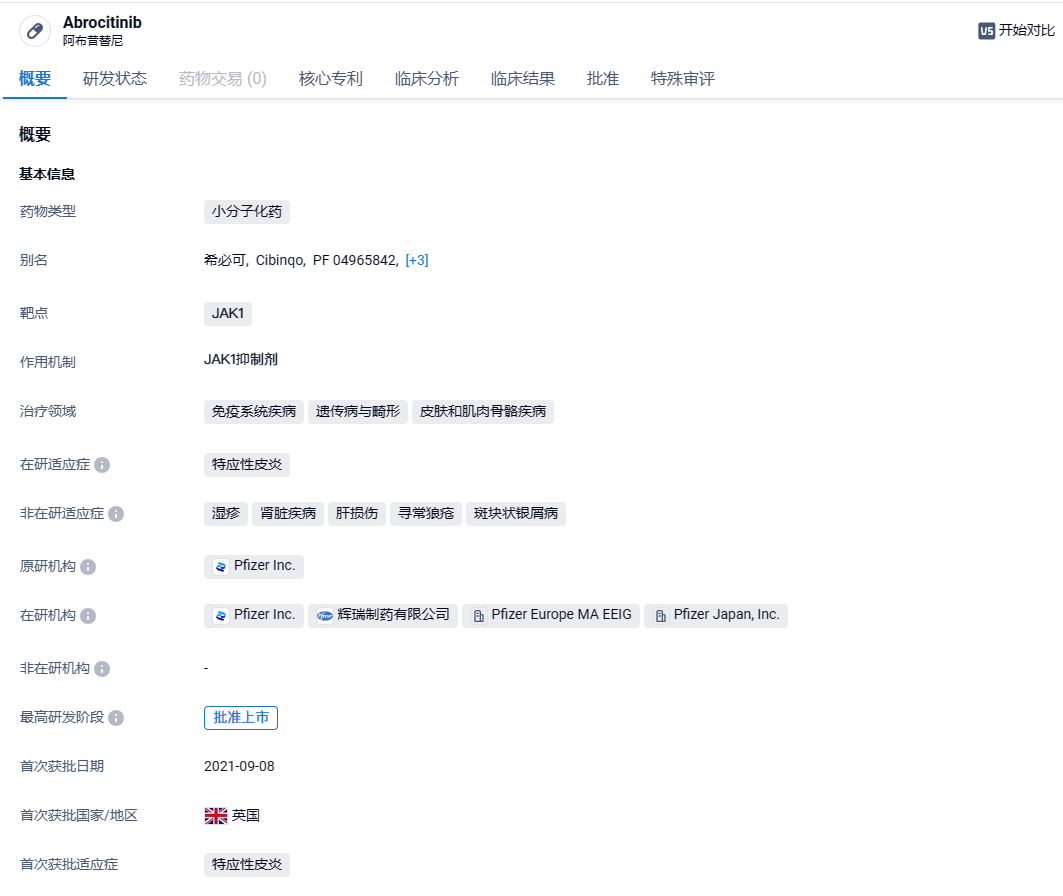
辉瑞JAK1抑制剂阿布昔替尼新适应症在华获批,针对青少年湿疹
2024年3月1日,国家药监局官网显示,辉瑞的阿布昔替尼获批新适应症,用于治疗对其它系统治疗药物应答不佳或不适宜上述治疗的难治性中度至重度特应性皮炎青少年(12至<18岁)患者。
阿布昔替尼是一种口服 Janus激酶1(JAK1)小分子抑制剂,能够通过阻断三磷酸腺苷(ATP)结合位点可逆性和选择性地抑制JAK1,调节白细胞介素(IL)-4、IL-13、IL-31、IL-22和胸腺基质淋巴细胞生成素等参与AD和瘙痒发病机制的细胞因子的信号传导,并最大限度地减少中性粒细胞减少和贫血的风险。该药品的上市为中重度AD患者提供了新的治疗选择。2021年9月,阿布昔替尼在英国首次获批上市,用于治疗成人和12岁以上青少年中重度特应性皮炎患者。2022年1月14日,美国FDA批准辉瑞公司CIBINQO®(Abrocitinib,阿布昔替尼)用于治疗中重度特应性皮炎(AD)的成人患者。2022年4月11日,中国NMPA批准阿布昔替尼片在中国上市。2023年9月19日,中国国家药品监督管理局药品审评中心(CDE)官网公示,辉瑞(Pfizer)口服JAK1抑制剂阿布昔替尼片(abrocitinib)上市申请拟纳入优先审评,拟定适应症为:用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎12岁及以上青少年患者。
阿布昔替尼在国内登记的一项用于12至<18岁中度至重度特应性皮炎患者的III期临床试验(CTR20190674)已于2021年6月29日完成。该研究旨在评估阿布昔替尼与背景外用药物联合治疗对外用治疗反应不佳或不适合治疗的12至<18岁青少年中度至重度特应性皮炎患者的有效性与安全性。该研究也是全球性III期JADE TEEN研究的一部分。JADE TEEN研究是一项随机、双盲、安慰剂对照的临床试验(n=287),评估了阿布昔替尼(100mg或200mg,每日1次)在中度至重度特应性皮炎青少年(12至<18岁)患者中的有效性和安全性。研究的主要终点为第12周实现研究者总体评估(IGA)为0/1的患者比例和在第75周达到湿疹面积和严重程度指数(EASI)改善75%以上(EASI-75应答)的患者比例。结果显示,与安慰剂组相比,阿布昔替尼组患者实现IGA为0/1的比例更多(100mg组41.6.%vs.200mg组46.2%vs.安慰剂组24.5%;P<0.05),达到EASI-75应答的患者比例也更多(100mg组68.5%vs.200mg组72.0%vs.安慰剂组41.5%;P<0.05)。
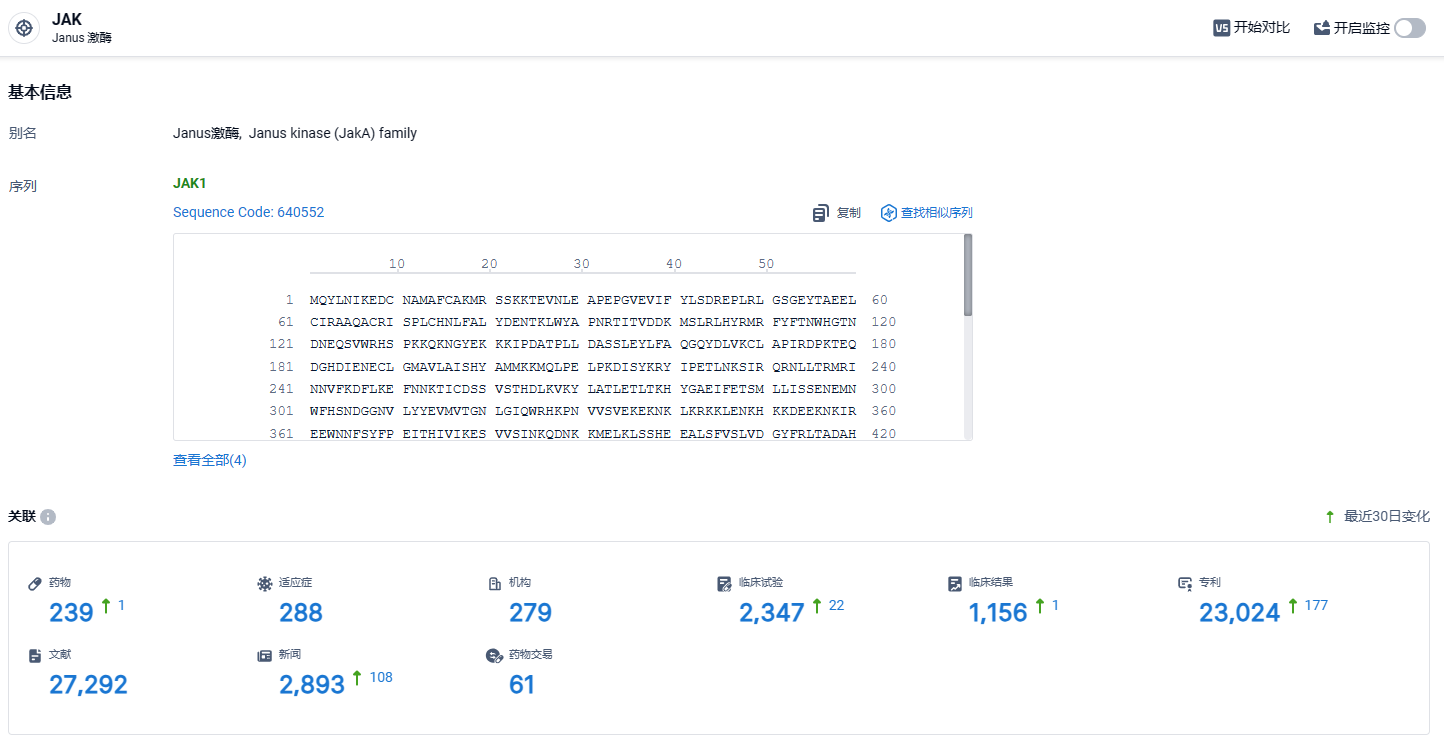
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 JAK靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年3月3日,JAK 靶点共有在研药物239个,包含的适应症有288种,在研机构279家,涉及相关的临床试验2347件,专利多达23024件……2022年JAK抑制剂市场已达近百亿美元,凭借着先发优势,一代泛JAK抑制剂仍占据主流市场地位。而以艾伯维为首的二代JAK抑制剂乌帕替尼正在逐步蚕食一代JAK抑制剂的市场份额。阿布昔替尼同样作为一款二代JAK抑制剂,有望在新一轮的竞争中崭露头角。