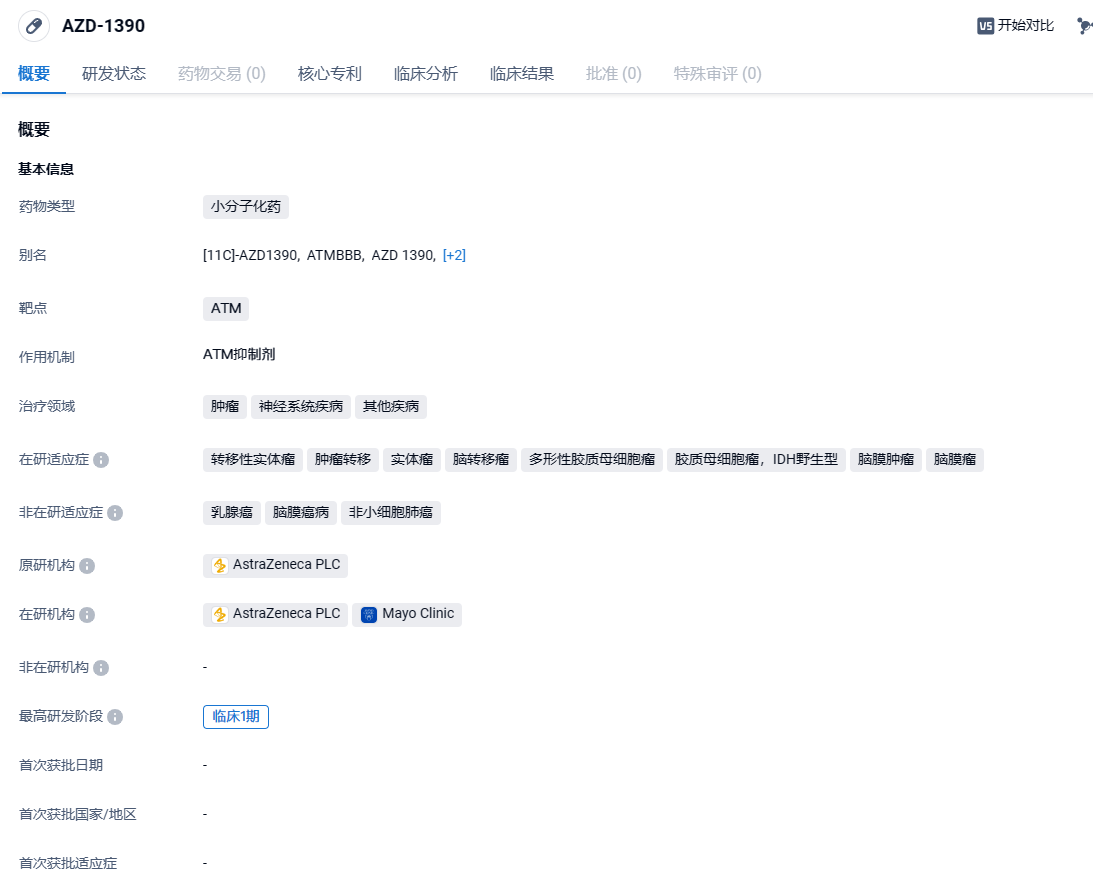
穿越血脑屏障!阿斯利康公布ATM激酶抑制剂AZD1390最新积极数据,针对脑癌
近日,阿斯利康(AstraZeneca)在美国癌症研究协会(AACR)年会上公布其在研ATM激酶抑制剂AZD1390全球1期试验的积极结果。
AZD1390是阿斯利康开发的一种具有口服活性的、能穿透中枢神经系统的ATM抑制剂,在细胞中IC50为0.78 nM。它对ATM的选择性是对PIKK家族其他相关酶的10,000以上,具有良好的选择性。作为一种ATP竞争性激酶抑制剂,AZD1390与放疗和其他化疗药物结合时表现出强大的抑癌活性。目前该药正在进行针对胶质母细胞瘤(GBM)的一期临床试验。
分析显示,当与标准放射疗法联合使用时,该疗法在复发性和新确诊的胶质母细胞瘤(GBM)患者表现出可控的安全性,并对复发性GBM患者显示出初步疗效。这项所公布的研究旨在评估AZD1390与放射疗法(IMRT)联用,在GBM患者中的安全性、耐受性、早期疗效和最大耐受剂量。截至2024年2月,该1期试验中有115例患者接受了AZD1390治疗,包括A组中75名复发性GBM患者和C组中36名新确诊的未甲基化MGMT基因启动子(uMGMT)的GBM患者。在两个组中,患者均接受逐渐增加的每日一次AZD1390剂量;A组患者接受10次分期35 Gy的IMRT治疗,为期两周;C组患者接受30次分期60 Gy IMRT治疗,为期六周。此外,在完成IMRT治疗后,患者接受两周的辅助AZD1390治疗。分析显示,在达到目标剂量的A组患者中观察到令人鼓舞的12.7个月中位总生存期(OS)。先前的研究表明,目前标准治疗可使患者OS达到6至10个月。C组的OS数据尚未成熟。在115例患者中,有18名(15.7%)经历了3级或4级AZD1390相关不良事件(AE);没有5级治疗相关不良事件。此外,4.3%的患者因与AZD1390相关的不良事件而停止AZD1390治疗。研究期间患者经历的大多数不良反应都是低度、易于控制、并且是可逆的。
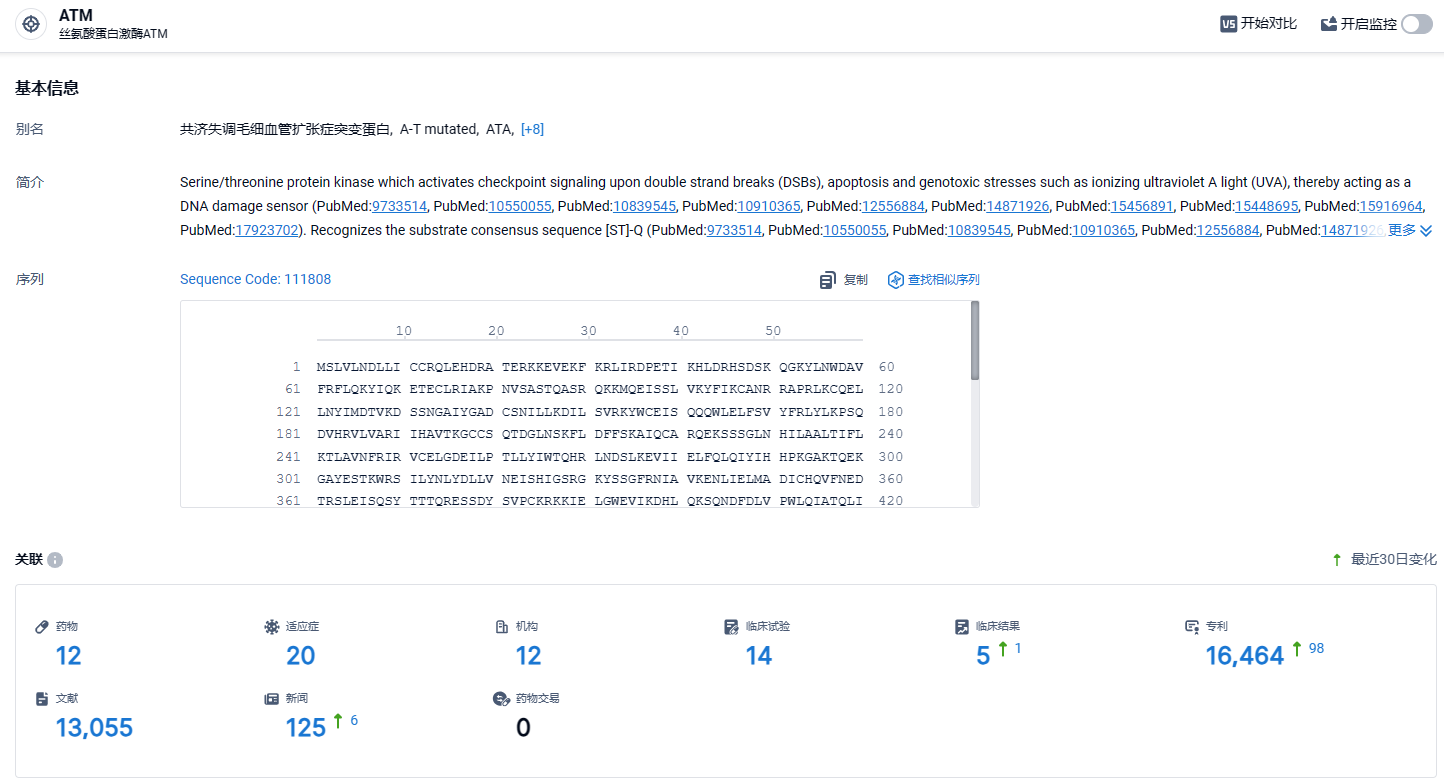
根据智慧芽新药情报库所披露的信息 (点击下方图片直达ATM靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年4月12日,ATM靶点共有在研药物12个,包含的适应症有20种,在研机构12家,涉及相关的临床试验14件,专利多达16464件……胶质母细胞瘤是一种恶性程度极高、致命性极强的脑癌。即便采取积极的治疗手段,患者的生存结局依然很差,平均生存期仅15-21个月,只有7%的患者能存活超过五年。因此,任何能改善患者预后的疗法,都非常重要!期待AZD1390能够研发顺利,为患者带来新的治疗选择。