德曲妥珠单抗II期临床DESTINY-Lung05最新研究数据公布,针对非小细胞肺癌
近日,在 2024 AACR 大会上,首次公布了德曲妥珠单抗(DS-8201)在既往经治 HER2 突变晚期 NSCLC 中国患者的 II 期临床 DESTINY-Lung05 研究数据。
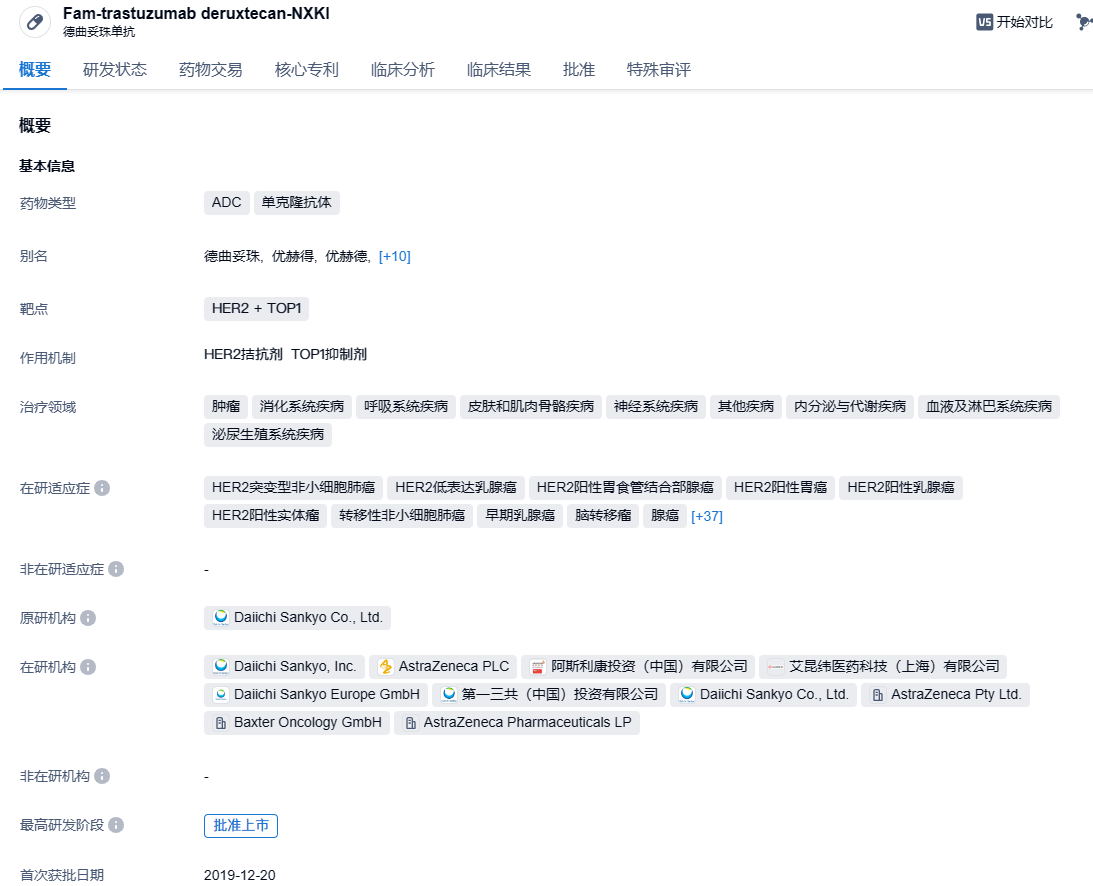
德曲妥珠单抗(Trastuzumab deruxtecan)(研发代号:DS-8201)是第一三共开发的一款抗体偶联药物(ADC),由抗HER2人源化单克隆抗体与载药拓扑异构酶Ⅰ抑制剂DXd(payload)通过可裂解连接子(linker)组成,其DAR值达理论最大值8,具有避免耐药、特异性强、高细胞毒性和安全性良好的特点。与HER2结合后,德曲妥珠单抗会破坏HER2信号,介导抗体依赖的细胞毒性反应,并通过内吞进入细胞内释放DXd,进而导致DNA损伤和细胞凋亡。此外,连接子与载药连接处的自切割修饰赋予的高效膜透过性,使德曲妥珠单抗能够发挥“旁观者效应”,克服瘤内异质性。本品最早由第一三共开发。2019年3月,阿斯利康与第一三共达成一项高达69亿美元的合作,在全球范围内共同开发和商业推广德曲妥珠单抗。2023年2月,注射用德曲妥珠单抗获得NMPA批准上市,单药适用于治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者。
DESTINY-Lung05 研究是一项开放性、单臂、II 期研究,旨在 DS-8201a 在接受 ≥ 1 次抗肿瘤治疗(无 HER2 定向治疗)后疾病进展、携带 HER2 19/20 号外显子突变的转移性非鳞状 NSCLC 中国患者的疗效和安全性。主要终点为经 ICR 评估确认的 ORR。次要终点包括:经研究者评估(INV)确认的 ORR、经 ICR 和 INV 评估确认的 DOR、DCR、PFS 和安全性。截至 2023 年 9 月 23 日,共有 72 名 HER2 突变 NSCLC 患者接受德曲妥珠单抗 5.4 mg/kg 治疗,中位随访时间为 9.8 个月。结果显示,经 ICR 评估确认的 ORR 达 58.3%(95%CI:46.1-69.8),其中有 1 例患者达到 CR,累计 41 例患者达到 PR。在次要研究终点中,ICR 评估确认的 DCR 为 91.7%,与 INV 的评估结果 93.1% 具有一致性。ICR 评估的中位 DOR 和中位 PFS 尚未达到研究终点,但已经显示出显著的改善趋势。INV 评估确认的中位 DOR 和中位 PFS 分别为 9.0 个月(95%CI:7.2,NE)和 10.8 个月(95%CI:7.2,NE)。安全性方面,共有 51.4% 的患者发生了 ≥ 3 级的药物相关不良事件,最常见的为中性粒细胞减少(26.4%)、血小板减少(18.1%)等。此外,药物相关性肺间质性疾病/肺炎发生率较低,仅为 9.7%。
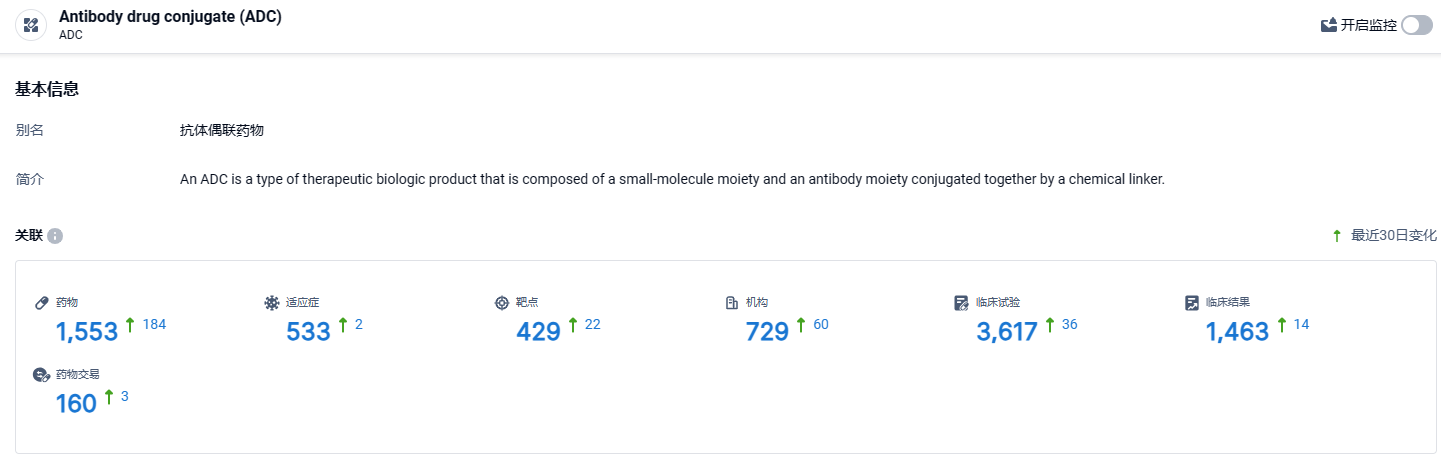
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 ADC 药物类型注册登录后可免费获得该药物类型下的在研药物、适应症、靶点、研发机构、临床试验等详细信息),截止到 2024年4月12日,ADC这一药物类型共有在研药物1553个,包含的适应症有533种,靶点429个,在研机构729家,涉及相关的临床试验3617件……ADC药物研发已成红海之势,而HER2更是布局更多的靶点之一。期待德曲妥珠单抗的后续表现。