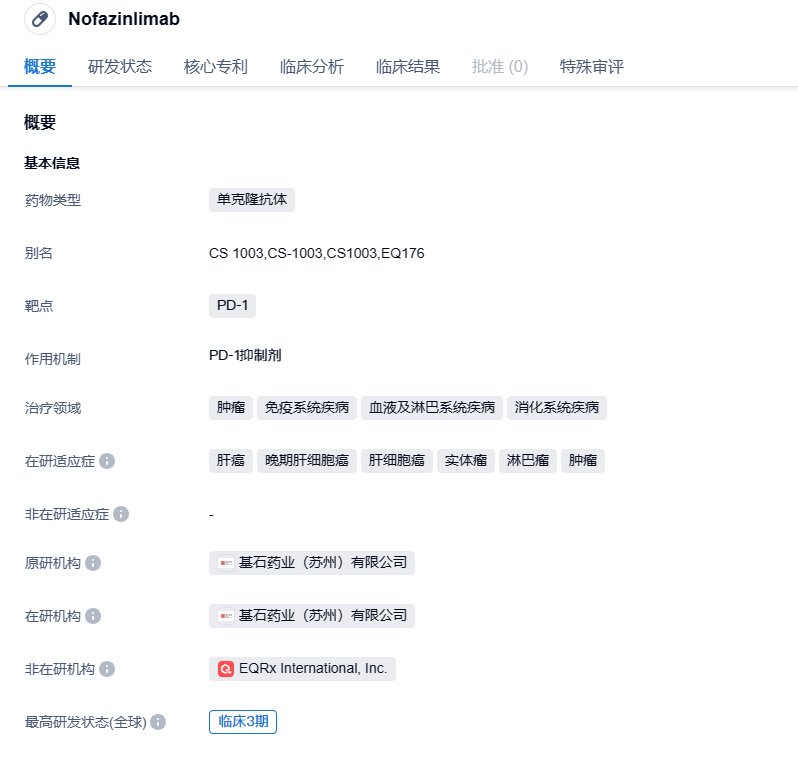
基石药业公布抗PD-1单抗Nofazinlimab 1期临床试验数据,治疗晚期实体瘤
2023年9月25日,基石药业宣布,国际肿瘤学期刊British Journal of Cancer发表了抗PD-1抗体Nofazinlimab(CS1003)治疗晚期实体瘤的首次人体试验(CS1003-101研究)数据。据悉,Nofazinlimab针对晚期肝细胞癌一线治疗的国际多中心3期临床研究预计将在2024年第一季度公布主要结果,该结果预期将用于支持Nofazinlimab在中国、美国、欧洲等国家和地区的注册上市。
Nofazinlimab是一种靶向人程序性细胞死亡蛋白1(PD-1)的人源化重组IgG4单克隆抗体,正在开发用于肿瘤的免疫治疗。Nofazinlimab与人类、食蟹猴和小鼠PD-1均具有高亲和力,可阻断PD-1与PD-L1和PD-L2配体的相互作用。Nofazinlimab已于2020年7月获美国食品药品监督管理局(FDA)授予孤儿药资格(Orphan Drug Designation,ODD),用于治疗肝细胞癌。2022年3月,Nofazinlimab联合仑伐替尼一线治疗晚期肝细胞癌患者的国际多中心III期注册性研究CS1003-305成功达成预设患者入组目标。2023年5月9日—基石药业终止与EQRx关于舒格利单抗与nofazinlimab的许可协议,重获肿瘤免疫治疗药物PD-L1抗体舒格利单抗与PD-1抗体nofazinlimab在大中华区以外的开发与商业化权益。
次公布的CS1003-101研究是一项1期、开放标签、剂量递增和剂量扩展研究,于2018年5月至2021年5月在澳大利亚和新西兰开展。研究数据表明,nofazinlimab单药治疗的安全性和耐受性良好,未观察到剂量限制性毒性(DLT),并在多个瘤种中观察到初步抗肿瘤活性。在该研究中也探索了不同的给药频率,数据表明,200mg nofazinlimab每三周给药一次(Q3W)和400mg每六周(Q6W)给药一次的方案在安全性和疗效方面基本一致。同时该研究还探索了nofazinlimab与多激酶抑制剂瑞戈非尼联合治疗剂量。数据显示,在经过多线治疗的转移性结直肠癌(mCRC)患者中,该联合治疗方案表现出良好的安全性。
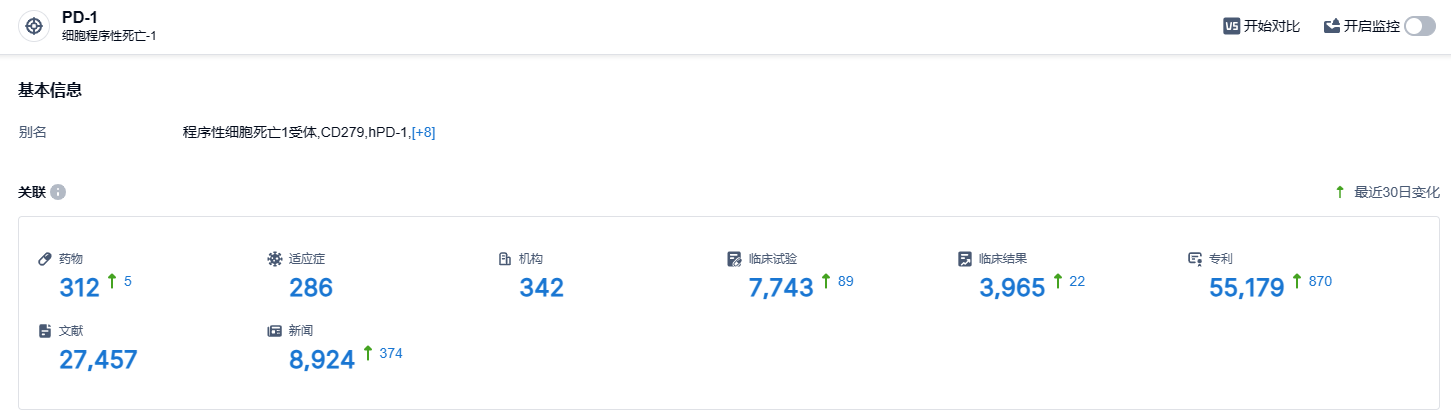
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 PD-1 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年9月27日,PD-1 靶点共有在研药物312个,包含的适应症有286种,在研机构342家,涉及相关的临床试验7743件,专利多达55179件……PD-1靶点是研发非常火热的领域,君实的特瑞普利单抗是国产新药的明星产品,期待该药的后续表现。