基石药业PD-L1单抗舒格利单抗在英国获批,治疗非小细胞肺癌
10月31日,基石药业宣布,英国药品和医疗保健用品管理局(MHRA)已批准舒格利单抗联合含铂化疗用于无EGFR敏感突变, 或无ALK, ROS1, RET基因组肿或无ALK, ROS1, RET基因组肿瘤变异的转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。这也是国产PD-L1单抗首次在英国获批上市。舒格利单抗是首个成功出海的国产PD-L1单抗,此前已于今年7月获得欧盟委员会批准上市,本次在英国的获批是其在海外市场获得的第二项上市许可申请批准。
舒格利单抗(商品名:择捷美®)是基石药业研发的一款抗PD-L1单抗。舒格利单抗注射液(sugemalimab,择捷美®)是由我国自主研发的一款抗PD-L1单克隆抗体,在患者体内产生免疫原性及相关毒性的风险更低,这使得舒格利单抗与同类药物相比,具有独特的优势。目前舒格利单抗在我国已有五大适应证获批,分别用于治疗:
1、同步或序贯放化疗后,未见疾病进展、不可切除、III期非小细胞肺癌(NSCLC)。
2、与化疗联合,作为转移性鳞状及非鳞状非小细胞肺癌(NSCLC)患者的一线治疗。
3、与铂类化疗药和氟尿嘧啶类药物联合,作为局部晚期、不可切除的、复发或转移性食管鳞癌的一线治疗。
4、用于复发或难治性的结外NK/T细胞淋巴瘤的治疗。
5、与铂类药物和氟尿嘧啶类联用,作为表达PD-L1(CPS≥5)的不可切除的局部晚期或转移性胃及胃食管结合部腺癌的一线治疗。

此次获批主要是基于一项多中心、随机、双盲的III期临床研究——GEMSTONE-302的结果。舒格利单抗联合化疗对比安慰剂联合化疗,可显著延长初治转移性NSCLC患者的无进展生存期和总生存期。该研究数据已在《柳叶刀·肿瘤学》(Lancet Oncology)和《自然·癌症》(Nature Cancer)上发表,并曾多次在国际学术会议上以口头汇报和壁报形式公布。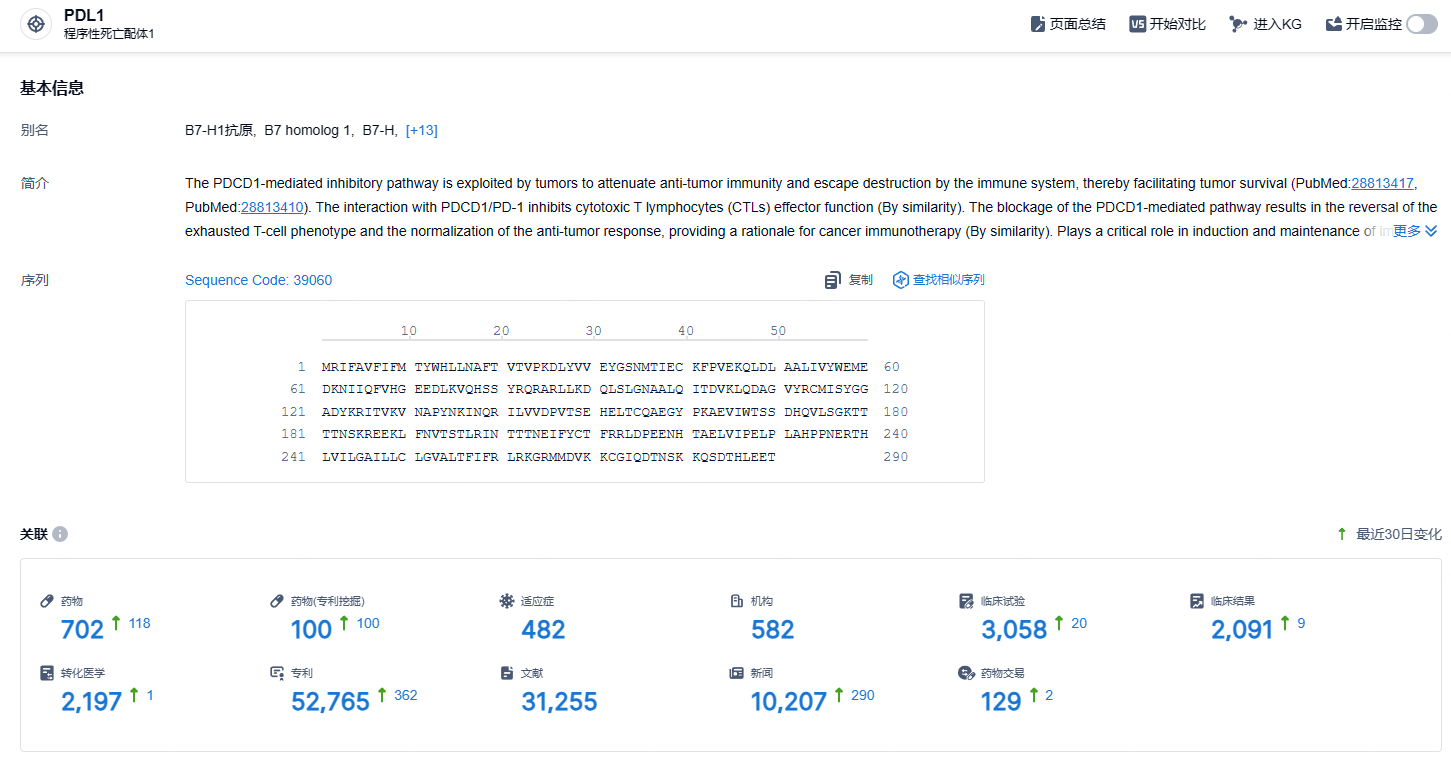
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PD-L1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年11月1日,PD-L1靶点共有在研药物702个,包含的适应症有100种,在研机构482家,涉及相关的临床试验3058件,专利多达52765件……海外商业化和注册方面,我们正积极与来自西欧、拉美、中东、东南亚、加拿大等地区的合作伙伴洽谈,预计近期将达成其中多项商业合作。同时,基石药业在积极与欧洲药品管理局(EMA)等国际监管机构沟通舒格利单抗其他适应症,如III期NSCLC、一线胃癌、一线食管鳞癌的上市申请,期待为全球更多患者带来创新的治疗方案。




