礼来阿尔茨海默病新药donanemab改良给药方案3b期研究成功,即将递交监管申请
10月29日,礼来公司宣布TRAILBLAZER-ALZ 6临床3b期研究达成主要终点。在24周时,具有早期症状的阿尔茨海默病(AD)成人患者在接受经调整的donanemab给药方案后,其发生水肿/渗出相关的淀粉样蛋白相关成像异常(ARIA-E)的风险与标准给药方案相比显著降低,且调整后给药方案在患者的淀粉样蛋白斑块和血浆P-tau217的减少方面与标准方案相当。礼来计划将此数据提交给全球监管机构,以期更新donanemab的标签。
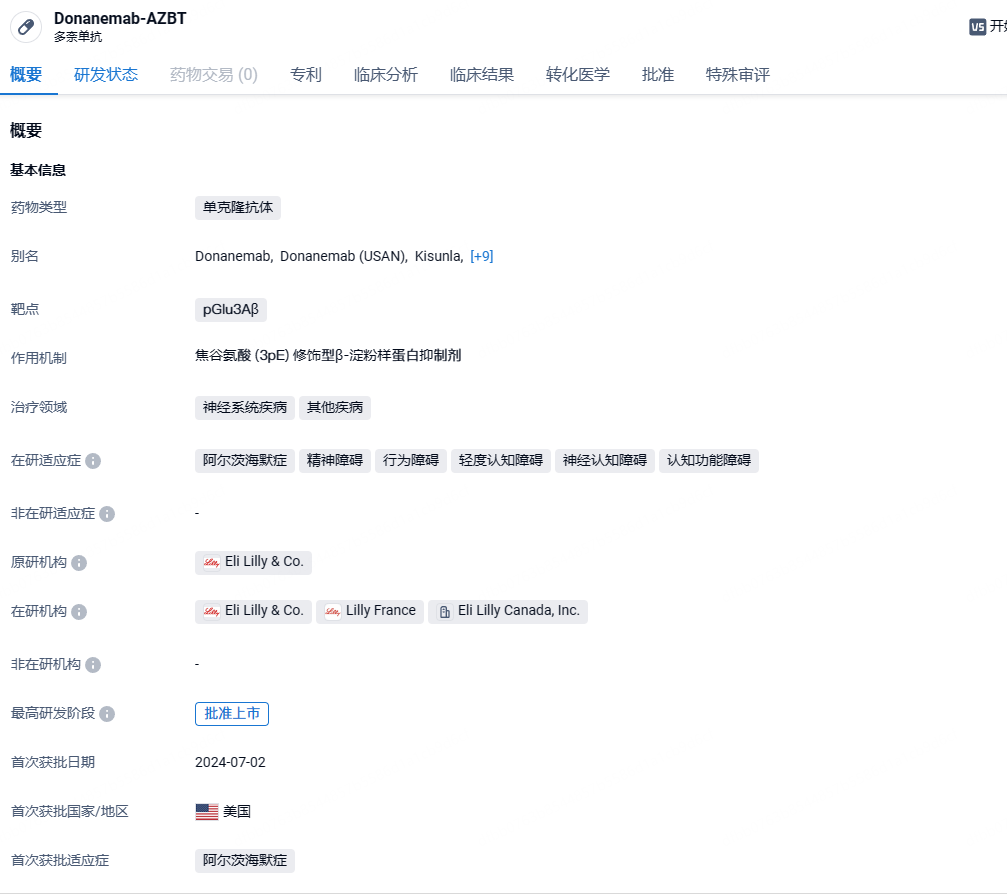
Donanemab(多奈单抗)是礼来在研的一款与β淀粉样蛋白亚型N3pG结合(pGlu3Aβ)的单克隆抗体,它能够与阿尔茨海默病患者大脑中沉积中的β淀粉样蛋白结合,从而促进患者大脑中淀粉样蛋白斑块的清除,改善患者的症状和体征,延缓疾病进展。2024年7月3日,美国FDA批准了礼来(Eli Lilly and Company)的Kisunla(donanemab),用于治疗出现早期症状的阿尔茨海默病(AD)的成年人。这些患者包括有轻度认知障碍(MCI)患者以及处于轻度痴呆阶段的AD患者,患者确认存在淀粉样蛋白病理。
TRAILBLAZER-ALZ 6是一项多中心、随机、双盲的3b期研究,旨在检视不同donanemab给药方案对早期症状性AD患者的ARIA-E发生率及淀粉样蛋白清除的影响。分析显示,接受调整后给药方案患者的ARIA-E发生率为14%,而接受标准给药方案患者的ARIA-E发生率为24%,调整后给药方案使发生ARIA-E的相对风险降低了41%;在APOE4纯合子患者中,调整给药方案带来的ARIA-E降低幅度最大,其中19%的患者发生ARIA-E,而标准给药方案的发生率为57%,相对风险降低了67%。
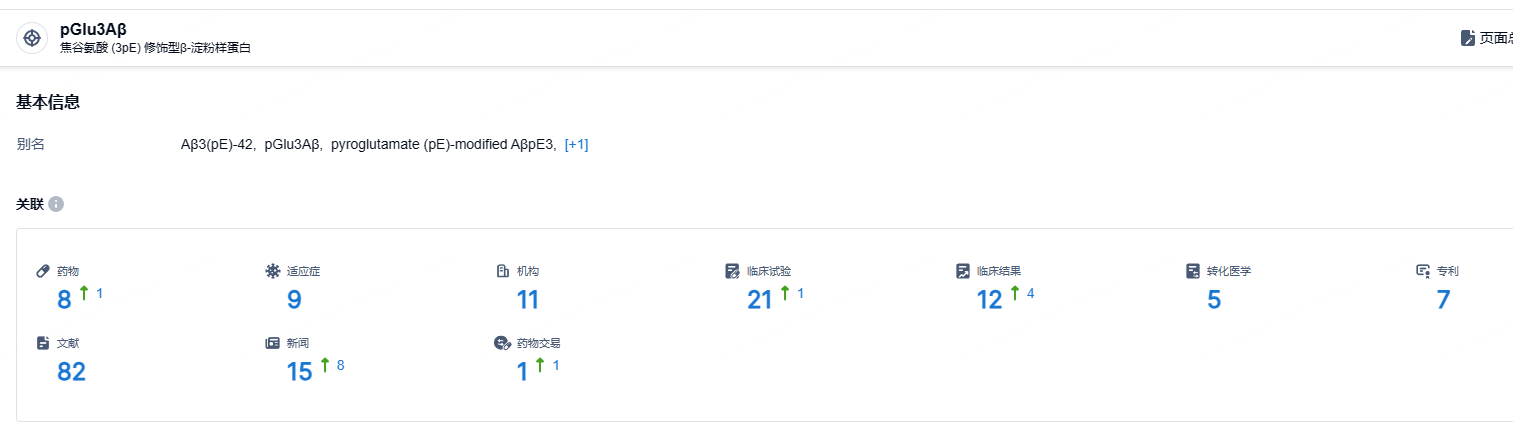
根据智慧芽新药情报库所披露的信息 (点击下方图片直达pGlu3Aβ靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年10月31日,pGlu3Aβ靶点共有在研药物8个,包含的适应症有9种,在研机构11家,涉及相关的临床试验21件,专利7件……GLP-1类新药和Donanemab是支撑礼来5000亿美元市值的核心,donanemab显著减缓了淀粉样蛋白阳性的早期症状性阿尔茨海默病患者的认知和功能下降,降低了疾病进展的风险。随着适应症的扩招,该药有望成为重磅炸弹药物。