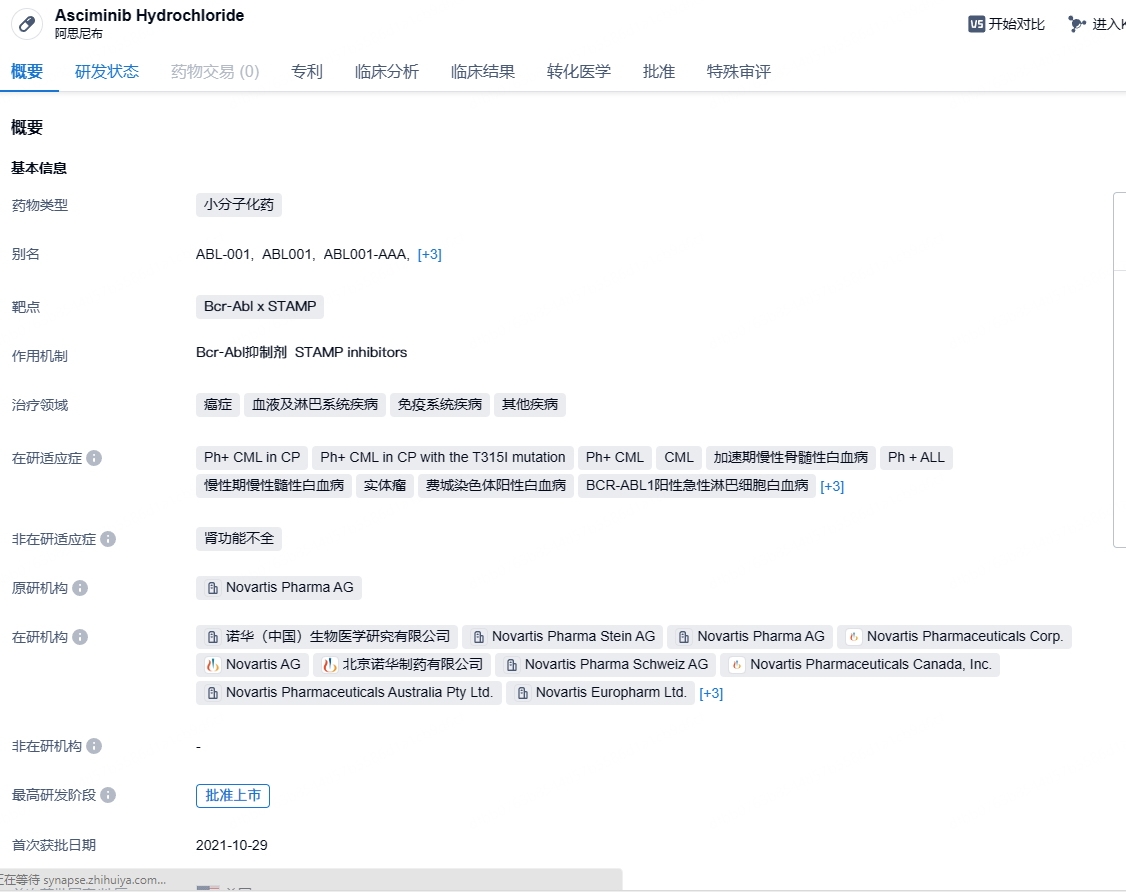
诺华STAMP抑制剂Asciminib获批一线治疗Ph+慢性粒细胞白血病
10月29日,诺华宣布Scemblix(Asciminib/阿思尼布)获FDA加速批准一项新适应症,治疗新诊断的慢性期费城染色体阳性慢性粒细胞白血病(Ph+ CML-CP)成人患者。
Scemblix(Asciminib/阿思尼布)是首个通过特异性靶向ABL豆蔻酰基口袋发挥作用的STAMP抑制剂,该药与Bcr-ABL1结合的位点不同于现有TKI,有望解决目前TKI常见的耐药和不耐受问题。此前于2021年10月,Scemblix已经在美国获批上市用于接受过两种或多种TKI治疗或具有T315I突变的Ph+ CML-CP成人患者,而此次治疗线数的前移将使Scemblix的适用人群增加大约4倍。
FDA此次批准是基于III期ASC4FIRST研究的积极结果。ASC4FIRST是第一项也是目前唯一一项与获批标准治疗(即第一代和第二代TKI)进行头对头比较的III期临床试验。
研究结果显示:
1.与IS SoC TKI(伊马替尼、尼洛替尼、达沙替尼和博舒替尼)相比,使用Scemblix®治疗的患者实现MMR的几率高出近20%(68% vs 49%,<0.001),与单独使用伊马替尼相比,第48周时实现MMR的几率高出近30%(69% vs 40%,<0.001)
2.Scemblix®是首个显示出优于伊马替尼和第二代TKI CML治疗药物,其安全性和耐受性也优于伊马替尼和第二代TKI,治疗相关≥3级ARs发生率更低(25.5% vs 33%和42%),剂量减少率更低(6% vs 14%和24%),导致治疗中止的ARs发生率降低一半(4.5% vs 11%和9.8%)
3.第48周时,使用Scemblix®治疗的患者对比单药治疗采用IS-TKI和伊马替尼的患者表现出更高的分子反应(包括MR4)(41% vs 22%和16%)。
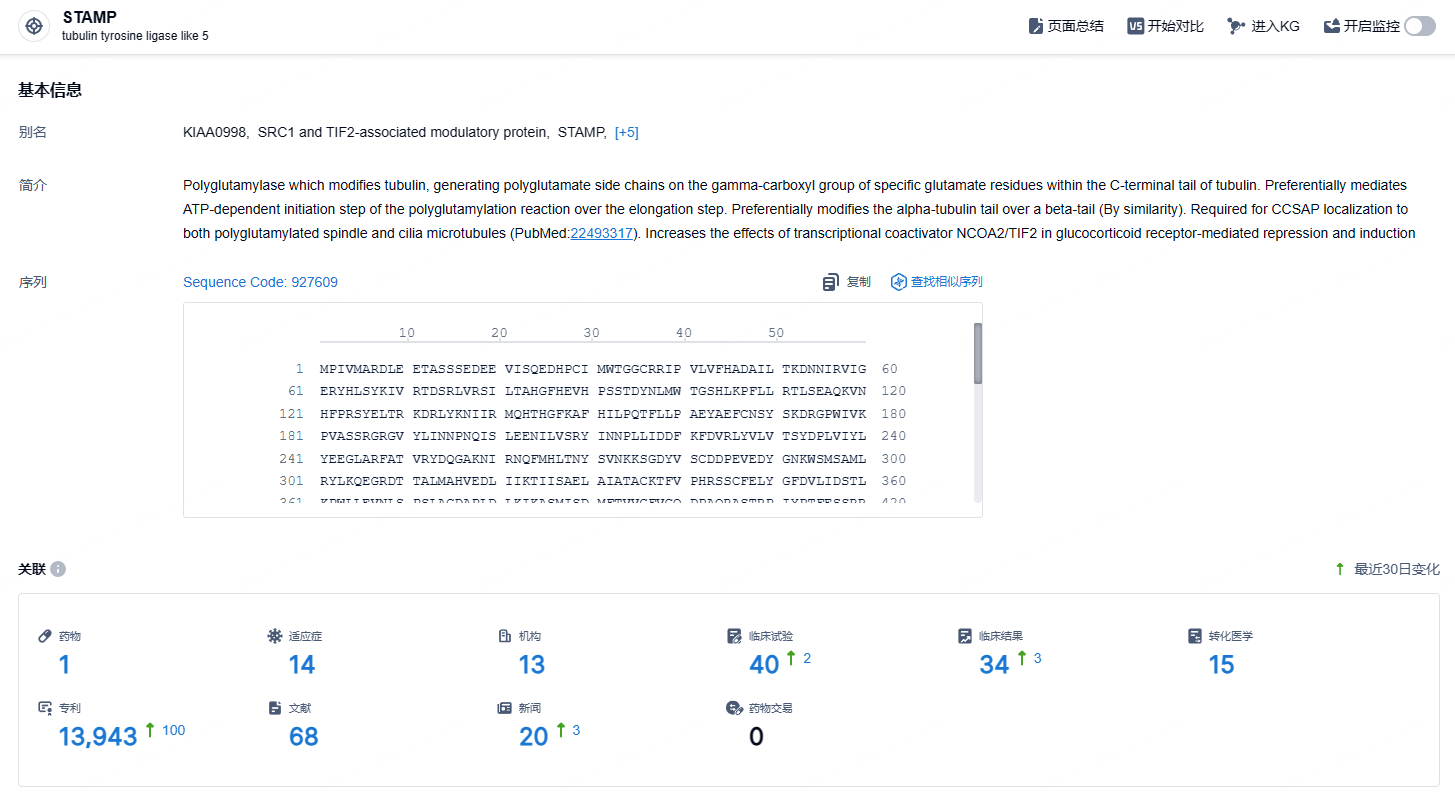
根据智慧芽新药情报库所披露的信息 (点击下方图片直达STAMP靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年10月31日,BTK 靶点共有在研药物1个,包含的适应症有14种,在研机构13家,涉及相关的临床试验140件,专利多达13943件……慢性粒细胞白血病的治疗挑战仍然存在,近50%的患者未能达到治疗的MMR里程碑,约25%的患者在一年内停止或转换治疗[5]。FDA对Scemblix的批准不仅扩大了符合条件的患者群体(约4倍),也为新诊断患者提供了更好的治疗机会。期待该药早日在我国获批。