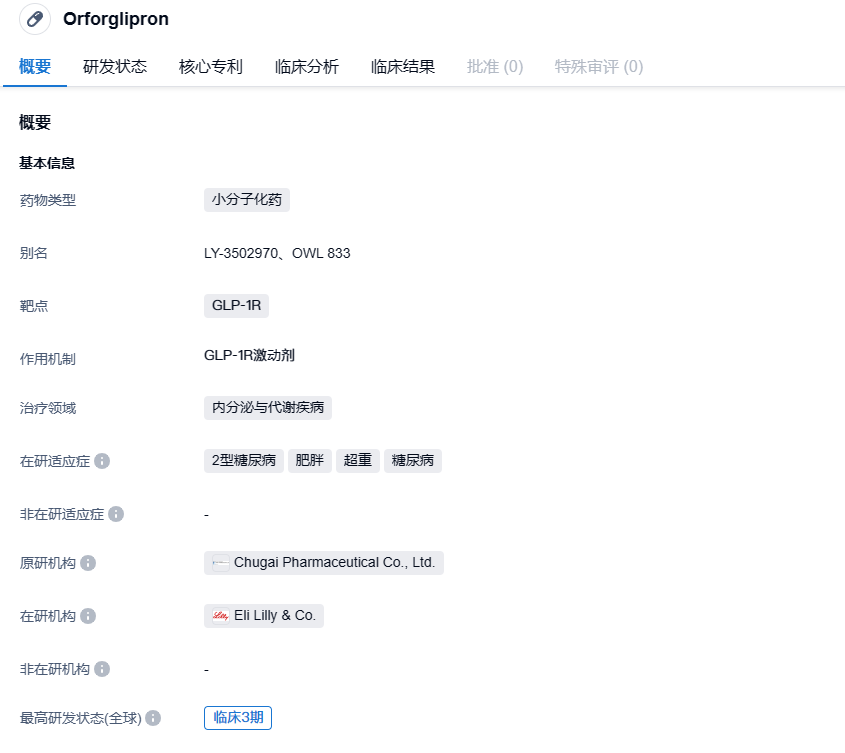
礼来口服GLP-1R激动剂LY3502970在中国启动3期临床,减重效果显著
2023年8月11日,中国药物临床试验登记与信息公示平台官网显示,礼来公司(Eli Lilly and Company)已经启动一项国际多中心(含中国)3期临床研究(ATTAIN-1研究),在肥胖或超重伴体重相关合并症的受试者中评价LY3502970(Orforglipron)与安慰剂相比的有效性和安全性。
Orforglipron是一款新型、高效、口服的非肽类GLP-1R激动剂,支持口服一天一次给药,由中外制药研发。2018年,礼来与中外制药达成合作,以5000万美元首付款获得Orforglipron的全球开发和商业化权益。除了减重适应症,orforglipron还被开发用于治疗2型糖尿病。礼来公司已启动 Orforglipron 的多项 III 期临床研究,以探讨其对肥胖和超重(ATTAIN 系列)和 2 型糖尿病(ACHIEVE 系列)的治疗效果和安全性。今年8月2日,礼来公司最在 ClinicalTrials.gov 上注册了一项名为 ACHIEVE-1 的 III 期研究。该研究旨在评估口服小分子 GLP-1R 激动剂 Orforglipron 对仅靠运动和饮食无法充分控制血糖的 2 型糖尿病成人患者的疗效 (NCT05971940)。
根据中国药物临床试验登记与信息公示平台官网公示,本次礼来启动的是一项3期、随机、双盲研究(ATTAIN-1),在肥胖或超重伴体重相关合并症的成人受试者中评价每日一次口服orforglipron与安慰剂相比的有效性和安全性。该研究主要目的是证明6mg、12mg和/或36mg每日一次orforglipron胶囊在控制体重方面优效于安慰剂。该研究拟在国际入组3000人,中国入组280人。
2023年6月23日,礼来公布了首款非肽口服胰高血糖素样肽-1(GLP-1)受体激动剂orforglipron的最新II期数据,该研究正在评估orforglipron用于肥胖或超重患者的慢性体重管理。该研究结果在美国糖尿病协会第83届科学会议上以口头报告形式分享,并同时发表在《新英格兰医学杂志》上。第26周的主要终点评估中,orforglipron组(12mg, 24mg, 36mg或45mg)在所有剂量下均显示出具有统计学意义的剂量依赖性体重减轻,减重范围为8.6%(19.8磅或9.0公斤)至12.6%(29.3磅或13.3公斤),而安慰剂组为2.0%(4.6磅或2.1公斤)。对于那些服用 orforglipron的受试者,体重在36周时持续下降,所有剂量的体重都有所减少,范围为9.4%(21.6磅或9.8公斤)至14.7%(34.0磅或15.4公斤),而安慰剂组的体重减少了2.3%(5.3磅或2.4公斤)。受试者的平均基线体重为240磅(109公斤)。orforglipron的安全性与其他以肠促胰岛素为基础的治疗相似。胃肠道副作用是最常报道的不良事件,严重程度一般为轻至中度,通常发生在剂量递增期间。
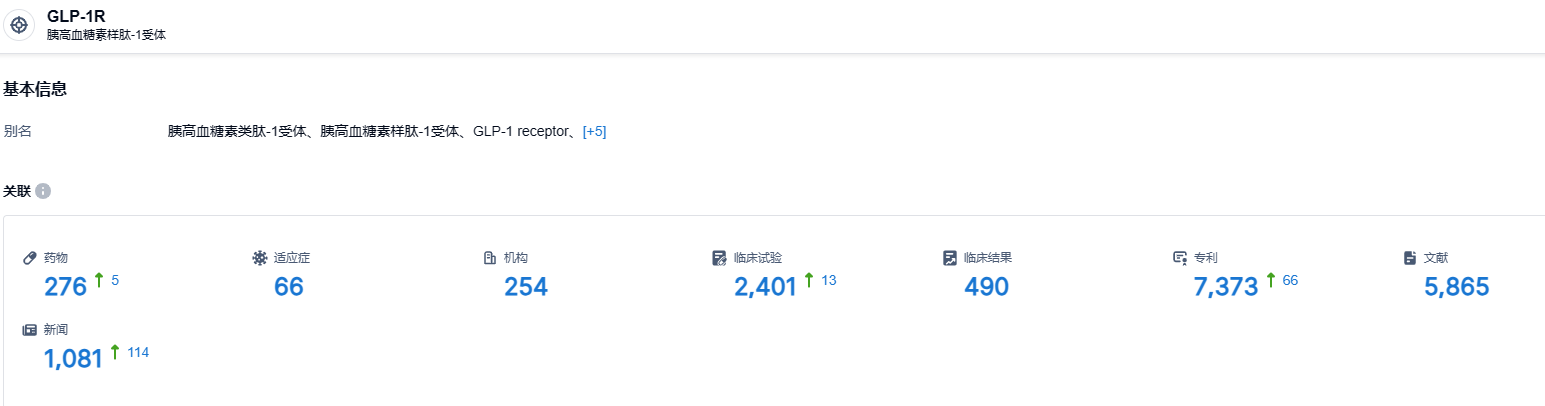
根据智慧芽新药情报库所披露的信息 (点击下方图片直达GLP-1R靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年8月12日,GLP-1R靶点共有在研药物276个,包含的适应症有66种,在研机构254家,涉及相关的临床试验2401件,专利多达7373件……GLP-1受体新药在降糖、减重等领域有着非常大的治疗潜力。除了本次启动临床的orforglipron,礼来其他减重新药如GCGR/GIPR/GLP-1R三重激动剂LY3437943、GIP/GLP-1受体双重激动剂tirzepatide等也正在中国开展针对超重或肥胖受试者的临床研究。作为GLP-1药物领域的领头羊之一,礼来深度全面的管线布局,值得国内药企的深入研究。