和黄医药递交c-Met抑制剂赛沃替尼新适应症上市申请,针对非小细胞肺癌
2024年3月27日,中国国家药监局药品审评中心(CDE)官网公示,和黄医药递交了赛沃替尼片新适应症上市申请,并获得受理。根据和黄医药近期发布的年度报告,该公司计划于2024年年初提交用于一线及二线治疗MET外显子14跳跃突变非小细胞肺癌患者的中国新药上市申请,有望将在中国的适应症拓展到包括一线患者。
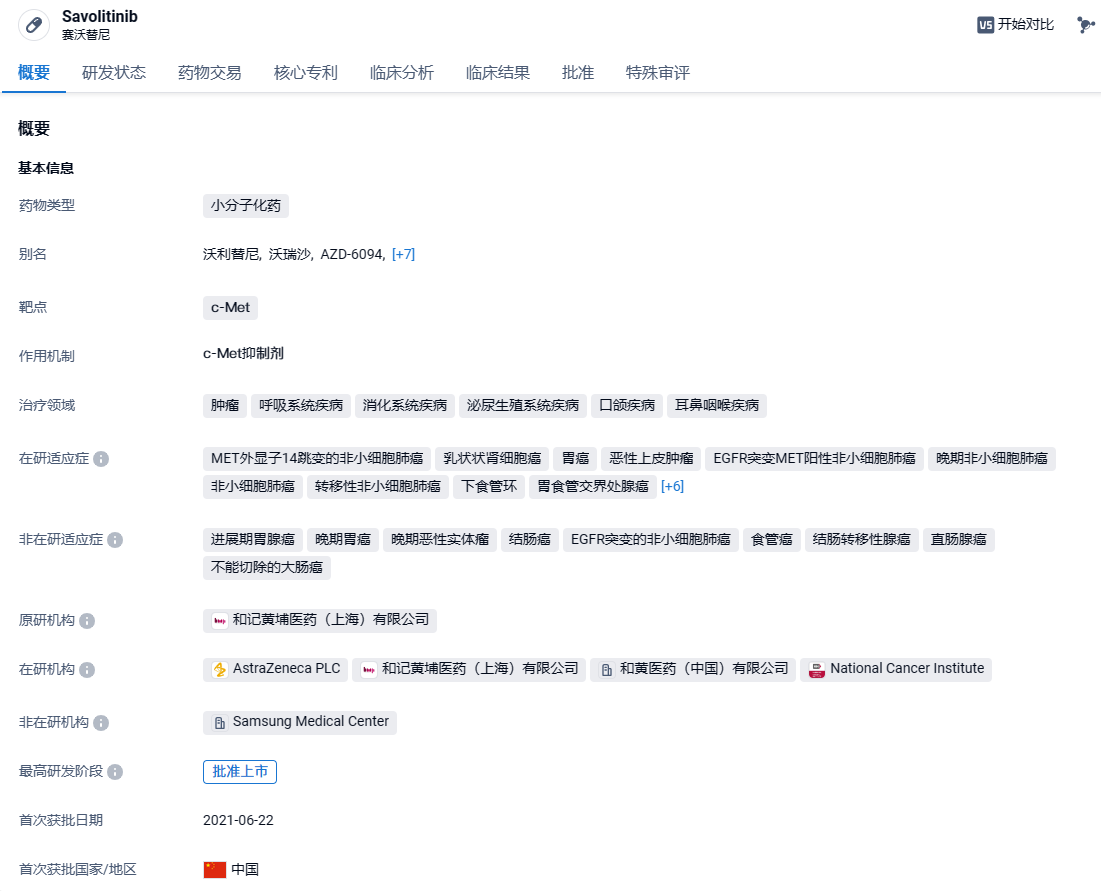
赛沃替尼是一种强效、高选择性的口服c-Met酪氨酸激酶抑制剂,在晚期实体瘤中表现出临床活性。赛沃替尼可阻断因突变 (例如外显子14跳跃突变或其他点突变)、基因扩增或蛋白质过表达而导致的MET受体酪氨酸激酶信号通路的异常激活。赛沃替尼在中国获批并以商品名沃瑞沙®上市,用于治疗接受全身性治疗后疾病进展或无法接受化疗的MET外显子14跳跃突变的非小细胞肺癌患者。目前,赛沃替尼正作为单药疗法或与其他药物的联合疗法,开发用于治疗包括肺癌、肾癌和胃癌在内的多种肿瘤类型。沃瑞沙®自2023年3月1日起获纳入国家医保药品目录,用于治疗含铂化疗后疾病进展或不耐受标准含铂化疗的MET外显子14跳跃突变的局部晚期或转移性非小细胞肺癌成人患者。2011年,和黄医药与阿斯利康达成一项全球许可协议,旨在共同开发沃瑞沙®并促进其商业化。和黄医药与阿斯利康合作负责赛沃替尼的临床开发,在中国由和黄医药主导,在海外则由阿斯利康主导。此外,和黄医药负责赛沃替尼在中国的上市许可、生产和供应,而阿斯利康则负责实现沃瑞沙®在中国乃至全球范围内的商业化。赛沃替尼的销售收入将由阿斯利康确认。
IIIb 期确证性研究 (NCT04923945) 的一线治疗队列的初步疗效和安全性数据已于 2023 年 9 月在国际肺癌研究协会 (IASLC) 主办的世界肺癌大会 (WCLC)上公布。该IIIb 期确证性研究的最终数据已于2024年3月20日在欧洲肺癌大会公布。
这项研究的数据为赛沃替尼作为MET外显子14跳跃突变的初治及经治非小细胞肺癌患者的靶向治疗选择提供了确认性的证据。在初治患者中,独立审查委员会评估的客观缓解率 ("ORR")为62.1% [95% 置信区间 ("CI") : 51.0%至72.3%]、疾病控制率 ("DCR")为92.0% (95% CI: 84.1%至96.7%)、中位缓解持续时间 ("DoR") 为12.5个月 (95% CI: 8.3个月至15.2个月)。至中位随访时间20.8个月的中位无进展生存期 ("PFS") 为13.7个月 (95% CI: 8.5个月至16.6个月) 及中位总生存期 ("OS") 尚未达到。在经治患者中,独立审查委员会评估的ORR为39.2% (95% CI: 28.4%至50.9%)、DCR为92.4% (95% CI: 84.2%至97.2%)、中位DoR为11.1个月 (95% CI: 6.6个月至未达到)。至中位随访时间12.5个月的中位PFS为11.0个月 (95% CI: 8.3个月至16.6个月) 及中位OS尚未成熟。初治和经治患者均较早出现缓解 (到达疾病缓解的时间1.4-1.6个月)。安全性特征可耐受,没有观察到新的安全信号。最常见的3级或以上药物相关治疗不良事件 (5%或以上的患者) 为肝功能异常 (16.9%)、谷丙转氨酶升高 (14.5%)、谷草转氨酶升高 (12.0%)、外围水肿 (6.0%) 及γ-谷氨酰转移酶升高 (6.0%)。
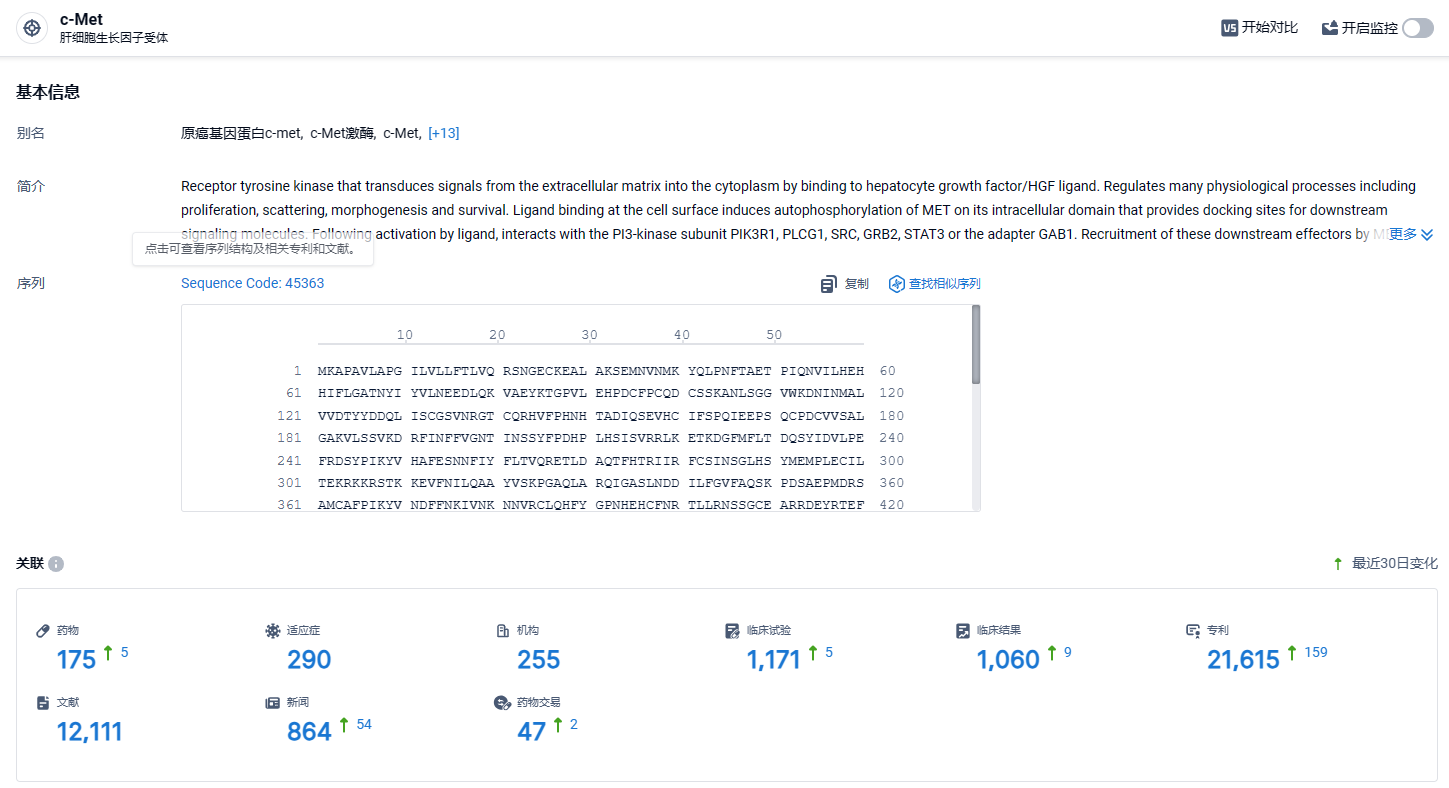
根据智慧芽新药情报库所披露的信息 (点击下方图片直达c-MET靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年3月28日,c-MET靶点共有在研药物175个,包含的适应症有290种,在研机构255家,涉及相关的临床试验1171件,专利多达21615件……多年来,研发领域涉及c-Met靶点的项目不在少数,目前已经有多款新药获批。期待赛沃替尼能够商业化之路一切顺利,为患者带来新的治疗选择。