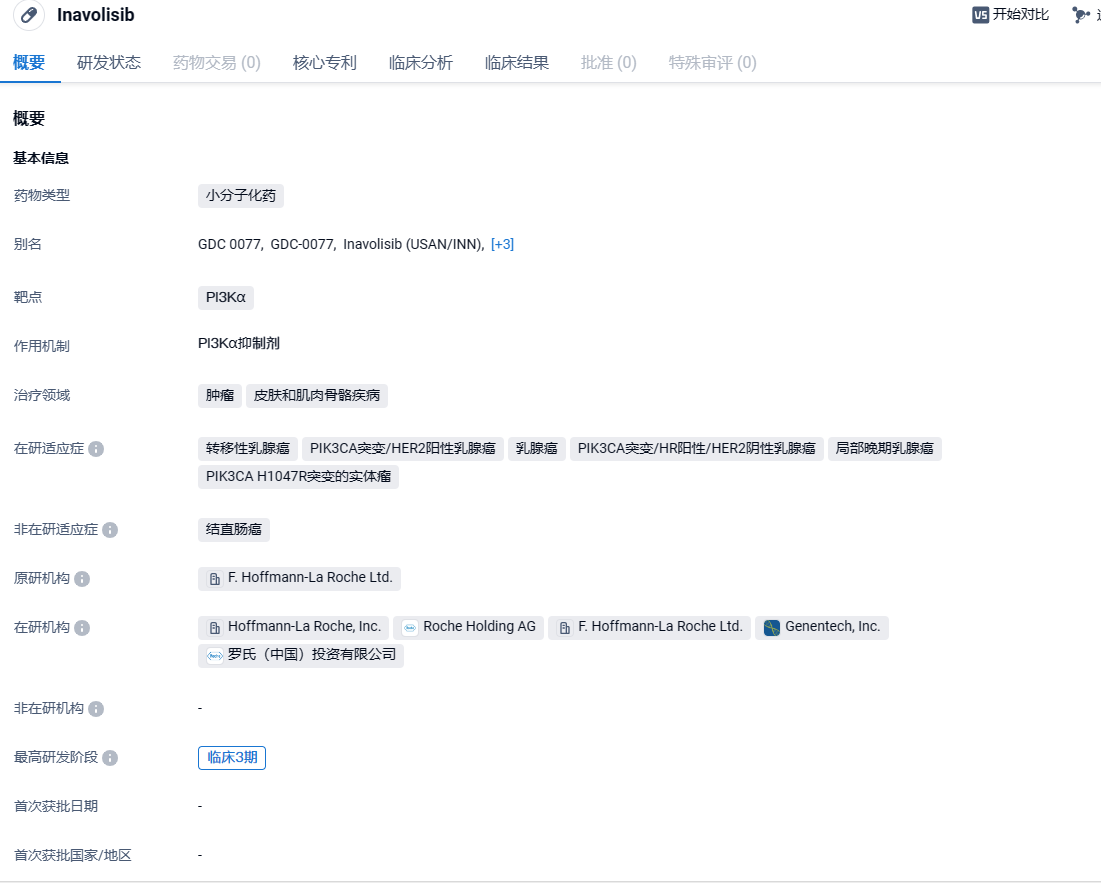
罗氏PI3Kα抑制剂inavolisib拟纳入突破性治疗品种,针对乳腺癌!
2024年3月25日,中国国家药监局药品审评中心(CDE)官网公示,罗氏(Roche)申报的GDC-0077(即inavolisib)拟纳入突破性治疗品种,针对适应症为:与哌柏西利和内分泌疗法联合用药适用于治疗PIK3CA突变、激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的局部晚期或转移性乳腺癌成人患者。
Inavolisib是一种具有同类最佳潜力的研究性口服靶向治疗药物,可为激素受体(HR)阳性、pik3ca突变的乳腺癌患者提供耐受性良好、持久的疾病控制,并可能改善预后,pik3ca突变是一种常见但经常被忽视的突变,约占该人群的40%Inavolisib被设计用于帮助最小化治疗的总体毒性,并且由于其对PI3Kα异构体抑制的高体外效力和特异性,以及其独特的作用机制,可导致突变PI3Kα的特异性降解,因此与其他PI3K抑制剂不同。
Inavolisib目前正在罗氏赞助的3项III期临床研究中进行研究,用于治疗pik3ca突变的局部晚期或转移性乳腺癌:帕博西尼联合氟维司汀与帕博西尼联合氟维司汀治疗一线hr阳性her2阴性乳腺癌(INAVO 120);在hr阳性her2阴性乳腺癌cdk4/6抑制剂和内分泌联合治疗(INAVO 121)后,联合使用氟维司汀vs.alpelisib+氟维司汀;帕妥珠单抗联合曲妥珠单抗皮下注射(Phesgo®)vs.Phesgo作为1Lher2阳性乳腺癌的维持治疗(INAVO 122)。
2023年12月,罗氏公布了inavolisib与CDK4/6抑制剂哌柏西利和氟维司群(内分泌疗法)联用,一线治疗局部晚期或转移性乳腺癌患者的3期临床试验(INAVO120)的积极结果。试验结果显示,与Ibrance和氟维司群联用的对照组相比,inavolisib组合疗法将疾病进展或死亡风险降低57%。该公司计划将这一结果递交给监管机构,目标是尽快为患者提供这一潜在治疗方案。试验结果显示,inavolisib组合疗法组的无进展生存期(PFS)为15.0个月,对照组为7.3个月(HR=0.43,95% CI:0.32-0.59,p<0.0001)。Inavolisib联合疗法的耐受性良好,不良事件与此前研究的已知安全性特征一致,未观察到新的安全信号。
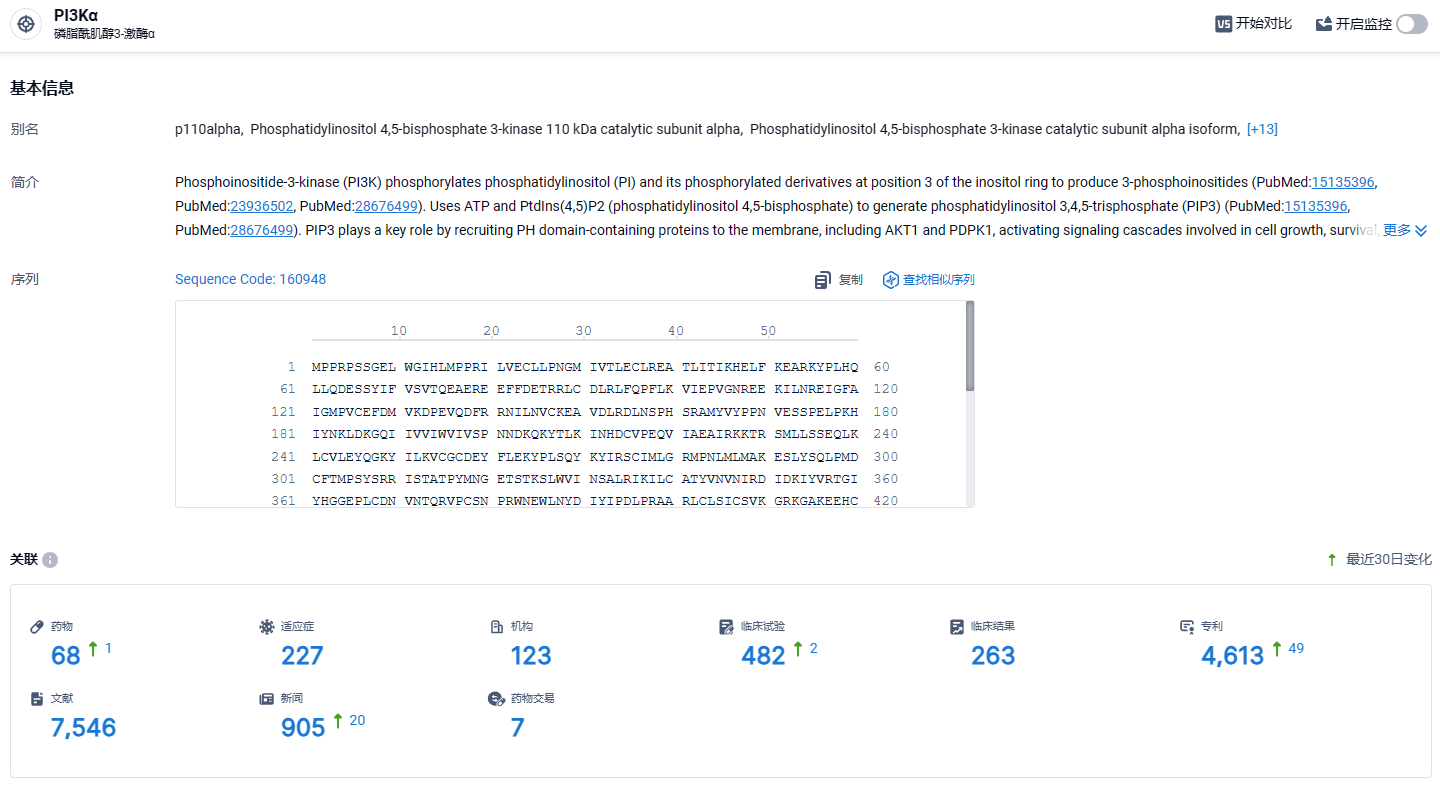
根据智慧芽新药情报库所披露的信息(点击下方图片直达PI3Kα靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2023年3月27日,PI3Kα靶点共有在研药物68个,包含的适应症有227种,在研机构123家,涉及相关的临床试验472件,专利多达4613件……罗氏的Inavolisib在III期研究中获得积极结果也是PI3K抑制剂传来的久违的好消息。期待Inavolisib后续研发顺利。