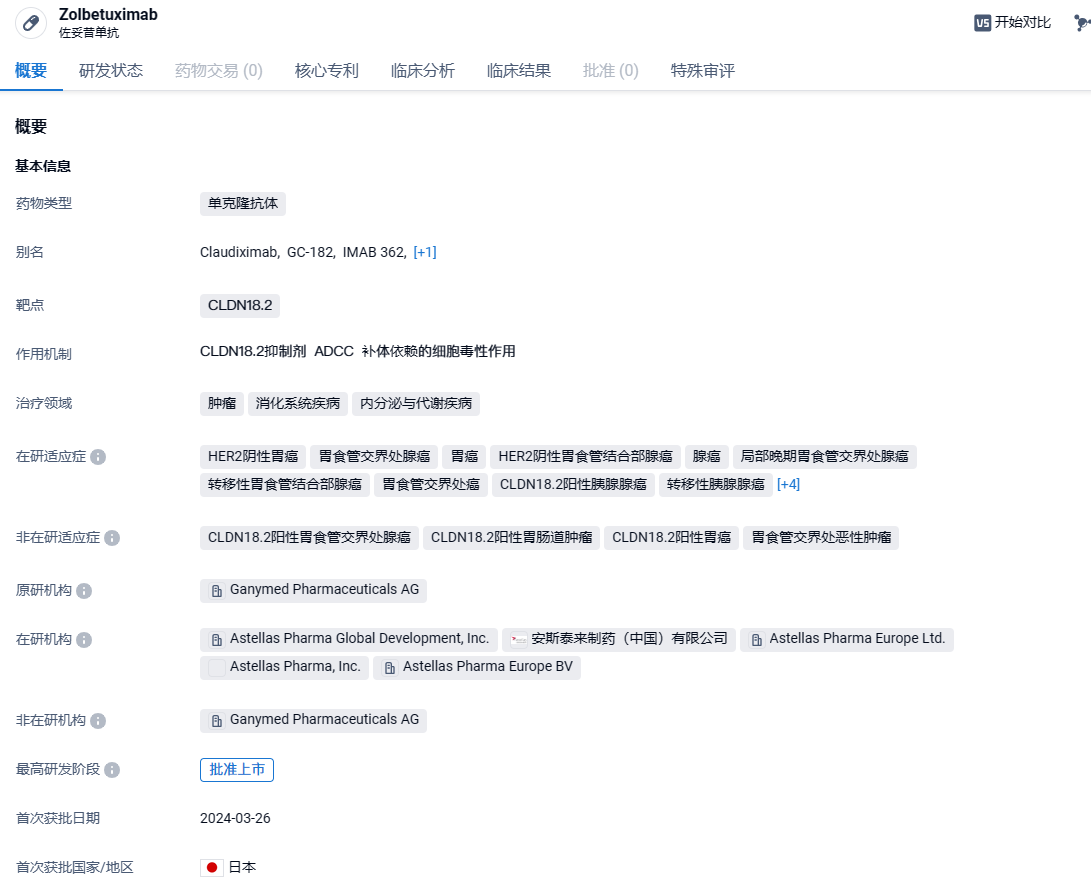
安斯泰来CLDN18.2单抗佐妥昔单抗在日本获批,针对胃癌,中国已申报上市!
2024年3月27日,安斯泰来(Astellas)宣布,日本厚生劳动省(MHLW)批准其靶向Claudin18.2(CLDN18.2)抗体zolbetuximab用于治疗CLDN18.2阳性、不可切除、晚期或复发性胃癌患者。值得一提的是,zolbetuximab(注射用佐妥昔单抗)在中国的上市申请已经于2023年8月获中国国家药监局(NMPA)受理。
佐妥昔单抗是最早是由Ganymed公司研发的一款靶向CLDN18.2的首创嵌合IgG1单克隆抗体,可与CLDN18.2结合,CLDN18.2是一种跨膜蛋白,Zolbetuximab通过与胃癌细胞表面的CLDN18.2结合发挥作用。2016年10月,Ganymed公司被安斯泰来以12.8亿欧元火速收购,而此次收购的核心资产就是Zolbetuximab。目前,Zolbetuximab一线治疗Claudin18.2阳性局部晚期不可切除或转移性HER2阴性胃或胃食管结合部(GEJ)腺癌的BLA正在美国接受优先审查,PDUFA日期为2024年1月12日。若顺利,Zolbetuximab将成为全球首款获批的CLDN18.2靶向药。临床前研究表明,这种结合作用随后通过激活两种不同的免疫系统途径——抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)诱导癌细胞死亡。2023年8月1日,CDE官网显示,安斯泰来注射用佐妥昔单抗(Zolbetuximab)上市申请获受理,用于治疗胃癌或胃食管交界处(GEJ)腺癌患者。这是国内首款申报上市的CLDN18.2单抗。此外,佐妥昔单抗已在美国、欧洲和日本申报上市。
此次zolbetuximab的获批主要基于两项III期SPOTLIGHT研究和GLOW研究临床试验的结果。SPOTLIGHT研究是旨在评估Zolbetuximab联合mFOLFOX6(一种包括奥沙利铂、亚叶酸和氟尿嘧啶的联合方案)一线治疗CLDN18.2阳性、HER2阴性的局部晚期不可切除或转移性G/GEJ腺癌患者的疗效和安全性。结果显示,与安慰剂联合mFOLFOX6组相比,Zolbetuximab与mFOLFOX6的联合用药组,在无进展生存期(PFS)和总生存期(OS)方面都实现了统计学意义的显著提升。具体而言,相比于安慰剂组,Zolbetuximab与mFOLFOX6联合用药将疾病进展或死亡风险降低了24.9%),达到主要研究终点。治疗组的中位PFS为10.61个月,安慰剂组为8.67个月。该研究还表明,Zolbetuximab与mFOLFOX6联合用药显著延长了OS,将死亡风险降低了25.0%。治疗组和安慰剂组的中位OS分别为18.23个月和15.54个月。
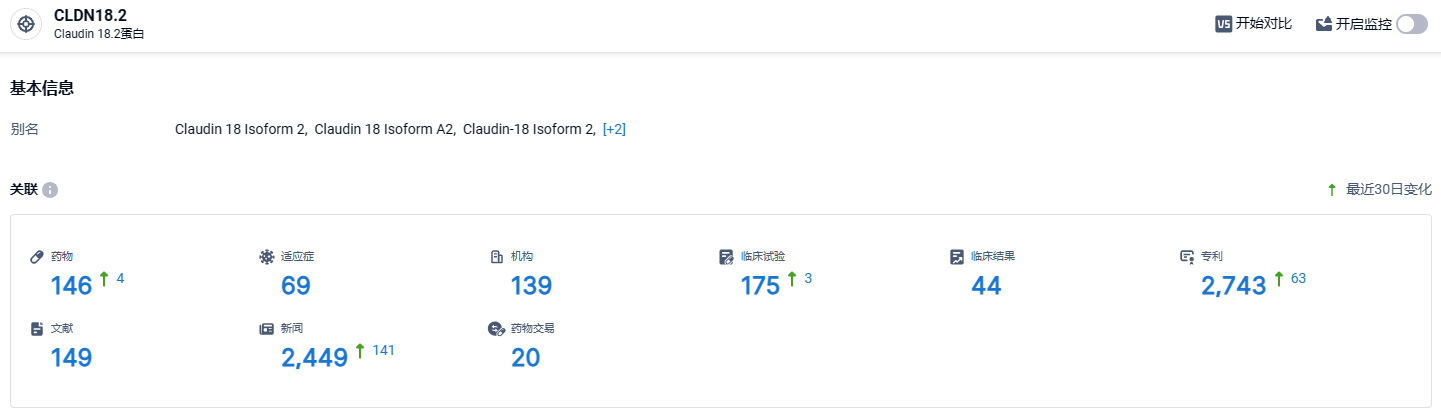
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 CLDN18.2靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年3月28日,CLDN18.2靶点共有在研药物146个,包含的适应症有69种,在研机构139家,涉及相关的临床试验175件,专利多达2743件……CLDN18.2靶点研发热度非常高,在国内外均有不少药企研发,期待国产CLDN18.2靶点新药能够尽早上市,与外企新药同台竞技。