Immatics公司TCR-T疗法IMA203获美国CBER授予RMAT认定,用于治疗多种癌症
日前,Immatics公司宣布,其在研T细胞受体T细胞(TCR-T)疗法IMA203获美国FDA生物制品评估和研究中心(CBER)授予再生医学先进疗法(RMAT)认定,用于治疗多种复发性和/或难治性HLA-A*02:01阳性和PRAME表达的癌症,包括皮肤黑色素瘤、葡萄膜黑色素瘤、子宫内膜癌、滑膜肉瘤和卵巢癌。
IMA203是基于Immatics公司ACTengine平台研发的自体TCR-T疗法,对患者自身的T细胞进行基因修饰,以表达针对靶标的TCR。此外,Immatics结合了其独有的细胞疗法生产平台,能够在6-10天内完成T细胞的基因工程改造和生产。该疗法靶向由HLA-A*02呈递的黑素瘤抗原PRAME。PRAME是一种在各种实体瘤中经常表达的蛋白质,因此IMA203具有治疗广泛癌症患者群体的潜力。
1b期剂量扩展试验在数据截止时,中位随访时间为8.5个月,数据尚未达到中位缓解持续时间,患者的初始客观缓解率(ORR)在第6周达到64%(7/11),第3个月的确认ORR为67%(6/9)。产生客观缓解的病患包含具低、中和高PRAME表达水平的各种实体瘤患者,例如检查点抑制剂耐药性的皮肤黑色素瘤、铂类耐药性卵巢癌、葡萄膜黑色素瘤、头颈癌和滑膜肉瘤。队列A患者在接受IMA203治疗时继续显示可控的耐受性,没有观察到高度细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS),也未观察到剂量依赖性CRS的增加。
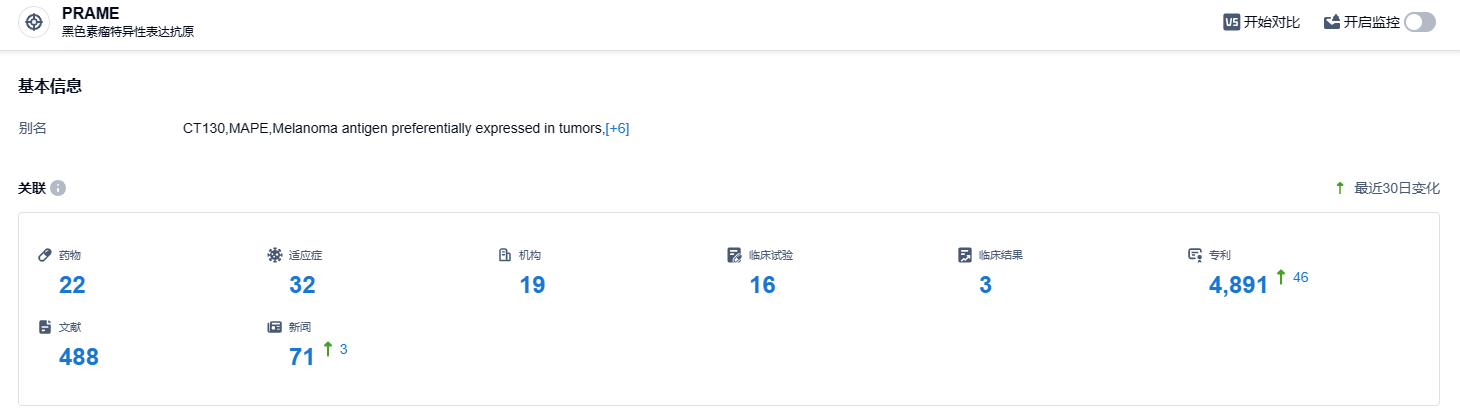
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PRAME 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年10月27日,PRAME靶点共有在研药物22个,包含的适应症有32种,在研机构19家,涉及相关的临床试验16件,专利多达4891件……这是美国FDA首次授予一款肿瘤候选疗法用于两种以上实体瘤适应症RMAT认定,期待IMA203能够早日上市。