信达生物玛仕度肽减重3期临床达主要终点和所有关键次要终点,近期提交上市申请
2024年1月9日,信达生物宣布GCGR + GLP-1R双重激动剂玛仕度肽(研发代号:IBI362)在中国超重或肥胖成人受试者中的首个3期临床研究(GLORY-1)达成主要终点和所有关键次要终点。信达生物计划于近期向中国国家药监局(NMPA)药品审评中心(CDE)递交玛仕度肽减重适应症的新药上市申请。
玛仕度肽是由礼来制药原研,信达生物于2019年引进的一款胃泌酸调节素创新化合物,是一种与哺乳动物胃泌酸调节素类似的长效合成肽。玛仕度肽结合并激活胰高血糖素样肽-1受体(GLP-1R)和胰高血糖素受体(GCGR), GLP-1R主要是促进胰岛素的释放,增加胰岛β细胞的再生,抑制β细胞的凋亡,降低胰高血糖素的释放。在胃肠道等组织中,GLP-1R可以通过与其激动剂结合抑制胃肠道的蠕动和胃液分泌,延迟胃的排空,增加饱食感。除了GLP-1R激动剂具有的促进胰岛素分泌、降低血糖和减轻体重等作用外,Mazdutide还可能通过激活GCGR,进而达到增加能量消耗和改善肝脏脂肪代谢的效应,与同类产品对比临床试验数据表现优异。临床前研究结果表明,在高尿酸血症大鼠模型中,不同剂量玛仕度肽与高尿酸血症一线治疗药物别嘌呤醇均可明显降低高尿酸血症大鼠的血尿酸水平,降幅约50%,而司美格鲁肽组未观察到类似效应;玛仕度肽组和别嘌呤醇组血肌酐及尿素氮水平也存在不同程度下降,与高尿酸血症对照组相比差异具有统计学意义;司美格鲁肽组血肌酐及尿素氮水平仅存在下降趋势,差异不具有统计学意义。此外,玛仕度肽组氧化应激和肾脏病理学形态指标也出现一定程度改善,有待进一步研究验证。
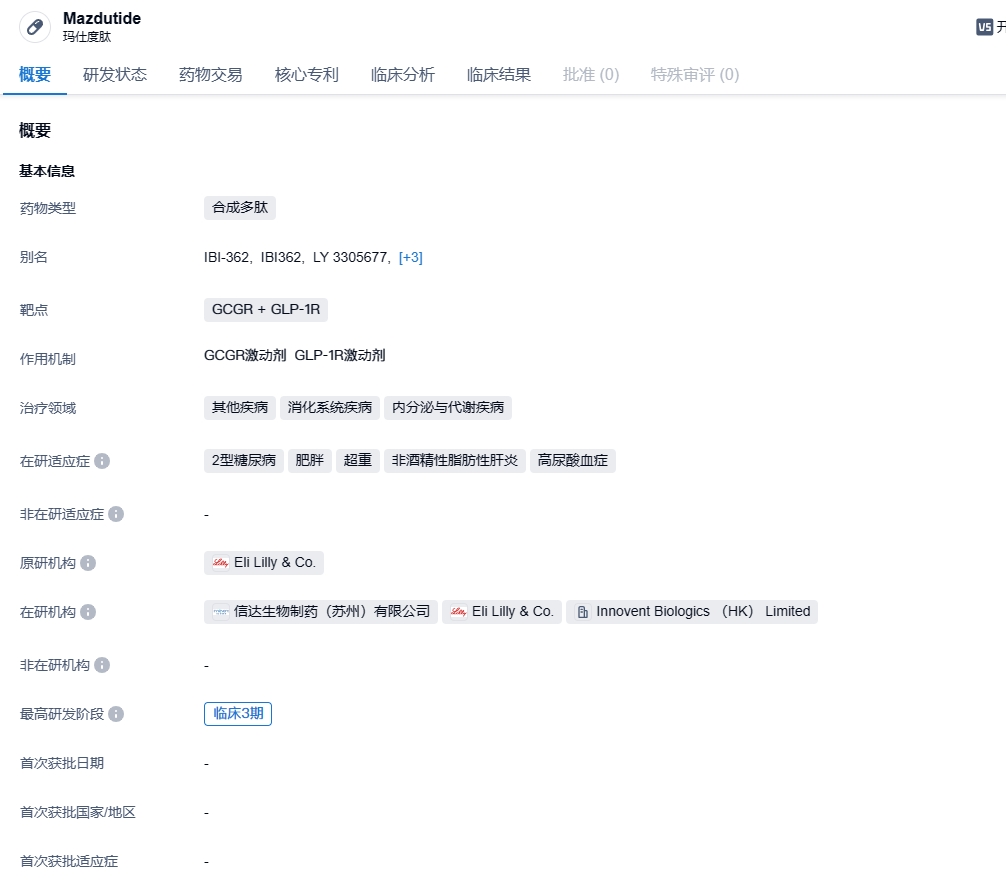
GLORY-1(NCT05607680)是一项在超重或肥胖受试者中评估玛仕度肽的有效性和安全性的多中心、随机、双盲、安慰剂对照的III期临床研究。研究入组610例受试者,随机分配至玛仕度肽 4 mg组、玛仕度肽 6 mg组或安慰剂组,双盲治疗48周。
研究结果显示,GLORY-1的两个主要研究终点均顺利达成:玛仕度肽 4 mg和6 mg组受试者治疗32周后体重相对基线的百分比变化,以及体重相对基线下降≥5%的受试者比例均显著优于安慰剂组;第48周时,玛仕度肽组的减重疗效较32周进一步提升。此外,该研究所有关键次要终点均顺利达成,包括与安慰剂相比,玛仕度肽组体重相对基线下降≥10%和≥15%的受试者比例、以及腰围、收缩压、甘油三酯、低密度脂蛋白胆固醇、总胆固醇、血尿酸和丙氨酸氨基转移酶水平相对基线的变化;玛仕度肽对以上体重和心血管代谢指标的改善均显著优于安慰剂。双盲治疗期内,玛仕度肽整体安全性良好,安全性特征与玛仕度肽的既往临床研究一致,未发现新的安全性信号。
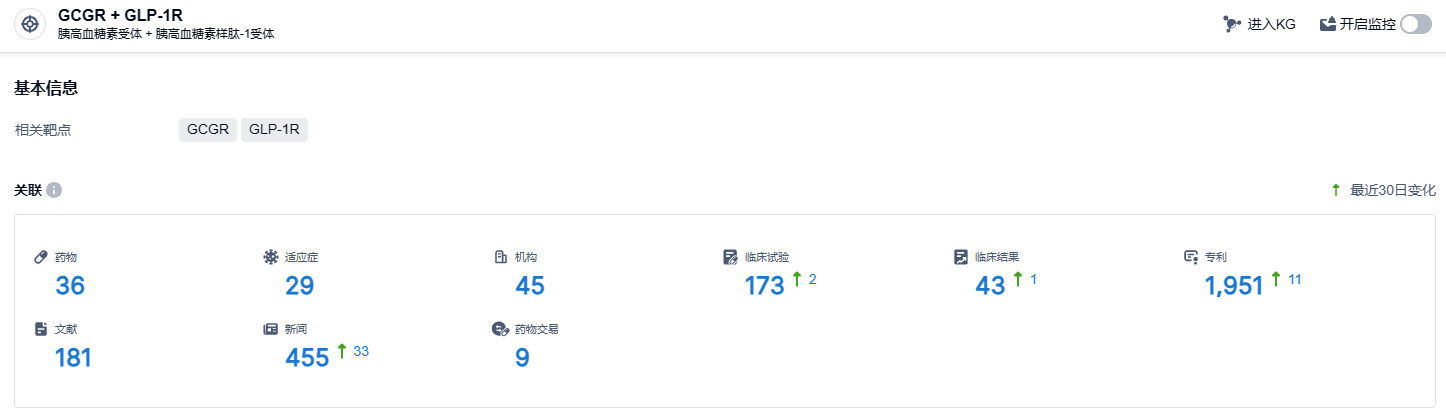
根据智慧芽新药情报库所披露的信息 (点击下方图片直达GCGR + GLP-1R靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年1月10日,GCGR + GLP-1R靶点共有在研药物36个,包含的适应症有29种,在研机构45家,涉及相关的临床试验173件,专利多达1951件……GLP-1R单靶点、多靶点药物在降糖、减重、降低血尿酸等内分泌疾病领域具有非常大的市场潜力,期待国产新药能够在该领域脱颖而出。