信达生物口头报告抗IGF-1R抗体IBI311两项临床数据,针对甲状腺眼病
2024年3月7日,信达生物宣布在第39届亚太眼科学会(APAO)年会和第21届国际内分泌学大会(ICE)以口头报告形式公布了抗IGF-1R单抗IBI311的两项临床研究结果,分别为:IBI311在健康受试者中的1期临床研究数据;以及IBI311在甲状腺眼病(TED)患者中的2期临床研究数据。值得一提的是,就在今年2月,信达生物宣布IBI311在中国甲状腺眼病受试者中开展的3期注册临床研究达成主要终点。
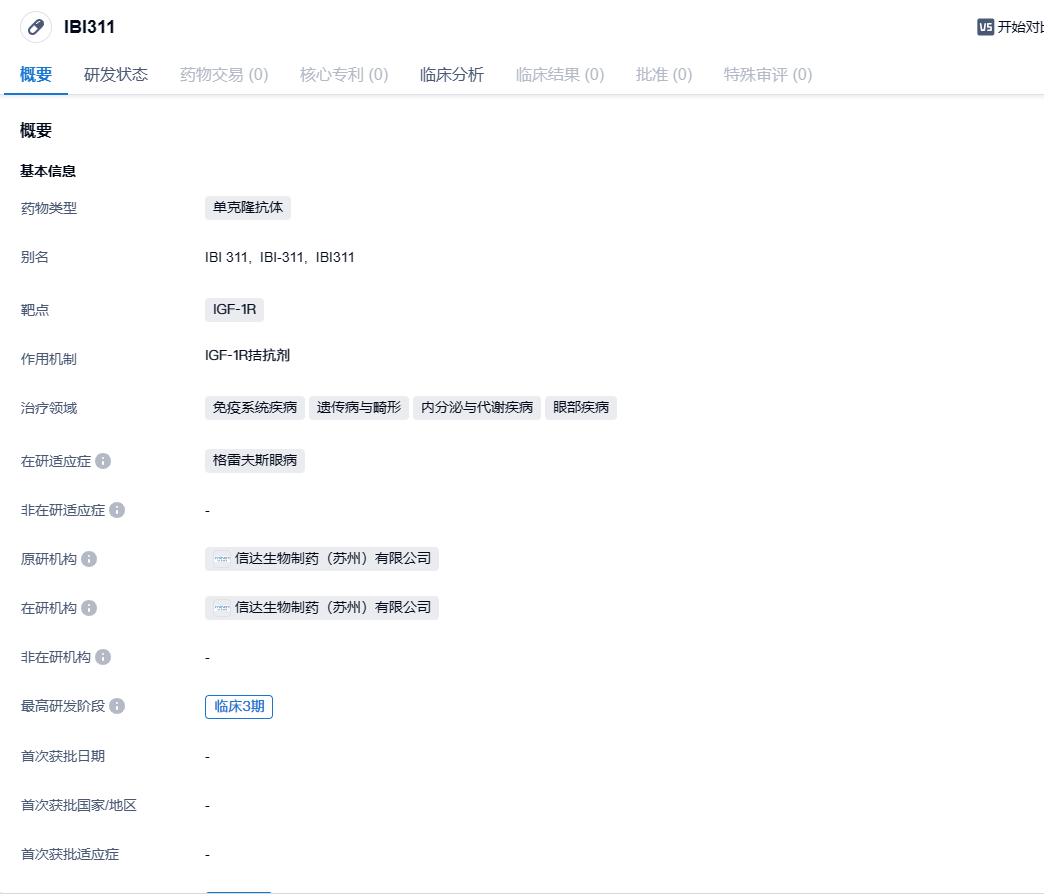
IBI311是靶向IGF-1R的单克隆抗体,可靶向结合IGF-1R蛋白,阻断配体胰岛素样生长因子1(IGF-1)和 IGF-2与IGF-1R的结合,并阻断相关配体或激动型抗体介导的 IGF-1R信号通路激活,减少下游炎症因子的表达,从而抑制OFs活化和OFs活化导致的透明质酸和其他糖胺聚糖合成,以及相关的炎症反应包括组织充血水肿等;抑制OFs脂肪细胞化,以减轻活动性甲状腺眼病患者的疾病活动度,改善突眼、复视、眼部充血水肿等症状。2024年2月20日,信达生物宣布其研发的重组抗胰岛素样生长因子1受体(IGF-1R)抗体注射液(研发代号:IBI311)在中国甲状腺眼病(TED)受试者中开展的III期注册临床研究(RESTORE-1)达成主要终点。该公司计划将向国家药品监督管理局(NMPA)药品审评中心(CDE)递交IBI311治疗TED的新药上市申请(NDA)。
IBI311(抗IGF-1R单克隆抗体)在中国健康受试者的I期研究
摘要编号:200683
在第39届亚太眼科学会年会的口头报告基于一项单次给药剂量爬坡的I期临床研究(NCT05480597),旨在评估在中国健康受试者中单次静脉输注IBI311的安全性和耐受性。研究的主要终点为安全性指标,次要终点包括药物代谢动力学(PK)参数和免疫原性结果。研究结果显示,IBI311安全性与耐受性良好,最常见的治疗期不良事件均为1级或2级,一过性,绝大多数未经治疗即自行缓解。研究期间,IBI311各剂量组抗药抗体均检测为阴性。提示健康受试者接受不同剂量下单次静脉注射IBI311的安全性和耐受性良好,且PK特征支持后续临床开发的剂量选择。
IBI311治疗甲状腺眼病(TED)的II期研究
摘要编号:#792
在第21届国际内分泌学大会的口头报告基于一项在中重度活动性TED受试者中开展的多中心、随机、双盲、安慰剂对照的II期临床研究(NCT05795621),旨在评估IBI311治疗TED的疗效和安全性。共33例合格受试者按2:1的比例随机分配并接受静脉注射的IBI311组或安慰剂组。研究主要终点为第12周时,研究眼的眼球突出应答率(定义为,研究眼眼球突出较基线减少≥ 2 mm,且不伴有对侧眼眼球突出增加≥ 2 mm的受试者百分比)。在12周后,所有受试者将继续接受IBI311治疗,持续至第21周。研究结果显示:
主要终点达成:第12周时,IBI311组研究眼的眼球突出应答率显著高于安慰剂组(59.1% vs 18.2%, OR=11.55, P= 0.0309),差异具有显著的统计学意义和临床意义。继续治疗并随访至第24周,IBI311治疗组的眼球突出度应答率可达72.7%,突眼较基线改善3.37mm,并观察到88.2%受试者符合复视应答(即复视改善≥1级)。安全性:总体安全性良好,绝大多数AE为轻度或中度,IBI311组无导致药物停用/暂停的治疗期不良事件。
以上结果提示:IBI311治疗12周即可显著地改善TED患者的突眼度,继续治疗可以带来突眼度进一步的改善以及复视改善等临床获益,并展现了良好的安全性。
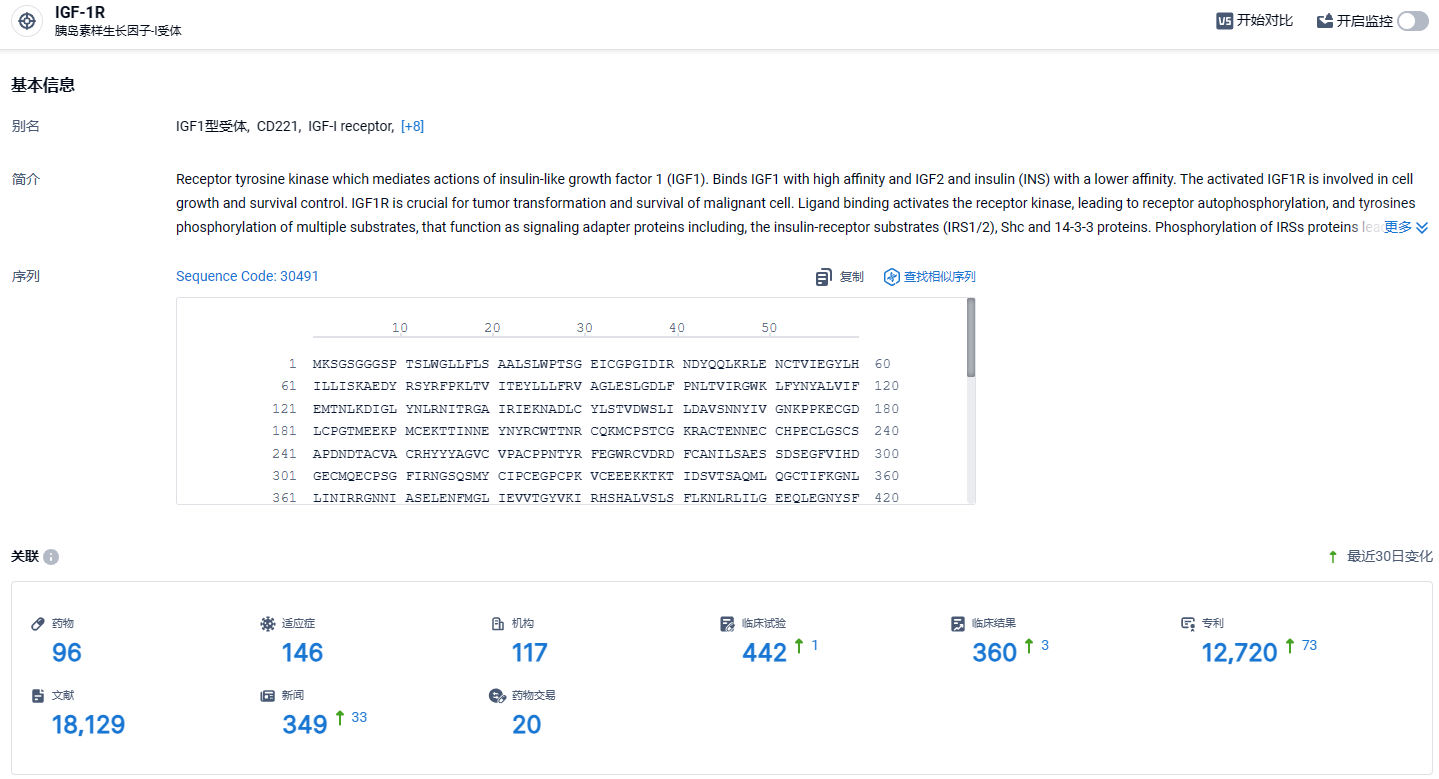
根据智慧芽新药情报库所披露的信息 (点击下方图片直达IGF-1R靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2024年3月8日,IGF-1R靶点共有在研药物96个,包含的适应症有146种,在研机构117家,涉及相关的临床试验442件,专利多达12720件……信达生物已有10个产品获得批准上市,分别是信迪利单抗注射液(达伯舒®),贝伐珠单抗注射液(达攸同®),阿达木单抗注射液(苏立信®),利妥昔单抗注射液(达伯华®),佩米替尼片(达伯坦®),奥雷巴替尼片(耐立克®), 雷莫西尤单抗注射液(希冉择®),塞普替尼胶囊(睿妥®),伊基奥仑赛注射液(福可苏®)和托莱西单抗注射液(信必乐®)。期待IBI311早日获批。