信达生物口头报告PD-1/IL-2α双特异性抗体融合蛋白IBI363临床数据
2024年6月14日,信达生物宣布,在2024年欧洲肿瘤内科学会(ESMO)六月全体大会上,该公司口头报告了PD-1/IL-2α-bias双特异性抗体融合蛋白IBI363治疗多种晚期实体瘤的临床数据。
IBI363是由信达生物自主研发的全球首创PD-1/IL-2α双特异性融合蛋白,同时具有阻断PD-1/PD-L1通路和激活IL-2通路两项功能。IBI363的IL-2臂经过了设计改造,保留了其对IL-2Rα的亲和力,但削弱了对IL-2Rβ和IL-2Rγ的结合能力,以此降低毒性;而PD-1结合臂可以同时实现对PD-1的阻断和IL-2的选择性递送。由于新激活的肿瘤特异性T细胞同时表达PD-1和IL-2α,这一差异性策略可以更精确和有效地实现对该T细胞亚群的靶向和激活。IBI363不仅在多种荷瘤药理学模型中展现出了良好抗肿瘤活性,在PD-1耐药和转移模型中也表现出了突出的抑瘤效力。从临床迫切需求出发,信达生物正在中国、美国、澳大利亚开展临床研究探索IBI363在针对各种晚期恶性肿瘤的有效性和安全性。
目前,信达生物正在中国、美国、澳大利亚开展临床研究,探索IBI363针对各种晚期恶性肿瘤的有效性和安全性。本次口头报告的研究为1a/1b期研究,旨在评估IBI363治疗晚期实体瘤受试者的安全性、耐受性和初步有效性。安全性方面数据显示,最常见的治疗相关不良事件(TRAE)是关节痛、贫血和甲状腺功能异常。三级或以上TRAE的总体发生率为23.9%,三级或以上免疫相关不良事件(irAE)的总体发生率为10.4%。3mg/kg Q3W剂量组的38例受试者中,13.2%的患者发生了三级或以上TRAE,安全谱与总体人群类似,未发现新的安全性风险。
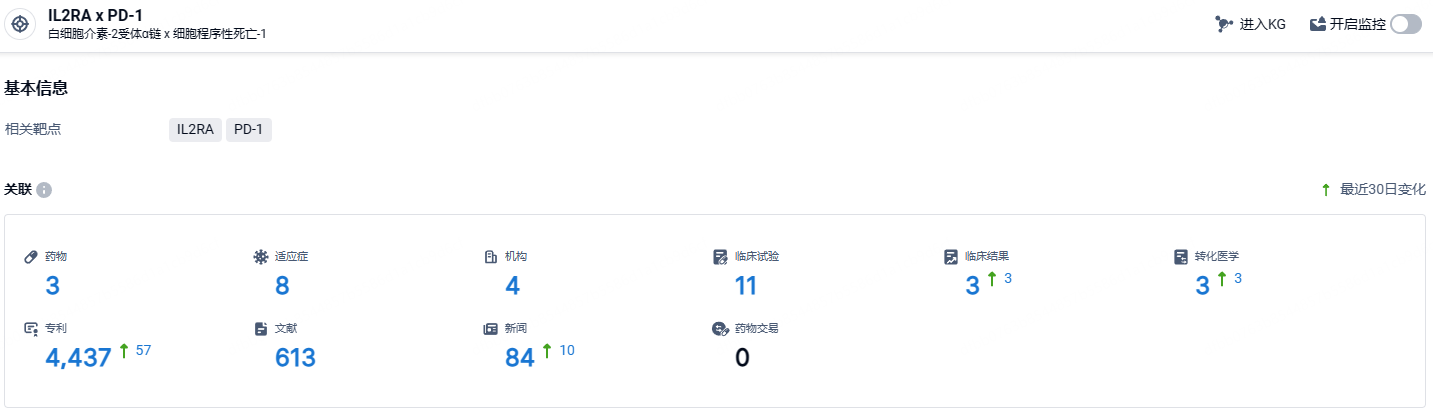
根据智慧芽新药情报库所披露的信息 (点击下方图片直达IL2RA x PD-1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年6月15日,IL2RA x PD-1靶点共有在研药物3个,包含的适应症有8种,在研机构4家,涉及相关的临床试验11件,专利多达4437件……黑色素瘤在中国人群中,以免疫治疗不敏感的肢端型和黏膜型黑色素瘤为主(约占60%~70%3)。IL-2作为激活肿瘤特异性CD8+T细胞的重要细胞因子,在机制上与免疫检查点抑制剂互补,可以扭转T细胞耗竭,是在黑色素瘤经过充分验证的靶点。IBI363作为PD-1/IL-2α-bias双特异性分子,初步研究结果提示在免疫耐药的黑色素瘤具有显著优于目前标准治疗的客观缓解率,并且缓解持久。期待IBI363后续研发顺利。