诺华宣布JAK抑制剂芦可替尼新适应症在华获批,针对慢性移植物抗宿主病
2024年6月13日,诺华(Novartis)公司宣布其JAK抑制剂磷酸芦可替尼片获得了中国国家药品监督管理局(NMPA)批准新适应症,用于治疗对糖皮质激素或其他系统治疗应答不充分的12岁及以上慢性移植物抗宿主病(cGVHD)患者。
芦可替尼是由Incyte开发的一款first-in-class JAK1/JAK2抑制剂,可通过抑制JAK信号通路来治疗多种自身免疫性疾病,其上市剂型包括片剂和乳膏。2009年11月,诺华与Incyte达成协议,获得芦可替尼在美国以外的开发和商业化权益,不过仅限于血液瘤适应症。2022年12月,康哲药业通过附属公司康哲美丽与Incyte公司就用于治疗自身免疫性炎症皮肤病的产品订立合作和许可协议。根据该等许可协议,康哲药业通过康哲美丽获得在中国大陆、香港、澳门、台湾地区以及及东南亚11国(印尼、菲律宾、越南、泰国、缅甸、马来西亚、柬埔寨、老挝、新加坡、东帝汶以及文莱)(“区域”)研发、注册及商业化磷酸芦可替尼乳膏的独家许可权利,以及在区域内生产磷酸芦可替尼乳膏的非独家许可权利。此前,芦可替尼片已于2023年获NMPA批准用于治疗对糖皮质激素或其他系统治疗应答不充分的12岁及以上急性GVHD(aGVHD)患者,并于2017年在中国获批用于中危或高危的原发性骨髓纤维化(PMF)、真性红细胞增多症继发的骨髓纤维化(PPV-MF)或原发性血小板增多症继发的骨髓纤维化(PET-MF)的成年患者,治疗疾病相关脾肿大或疾病相关症状。
一项随机、开放性、III期临床研究(REACH3)比较了芦可替尼与当前最佳可用疗法(BAT)治疗异基因干细胞移植后中、重度糖皮质激素难治性或依赖性cGVHD患者(≥12岁)的疗效,结果表明,芦可替尼的疗效优于BAT。第24周时,芦可替尼治疗组的总缓解率明显高于BAT组(49.7% vs. 25.6%;P<0.0001),最佳总缓解率更高(76.4% vs. 60.4%;P=0.0011)。在不同受累器官的疗效方面,芦可替尼治疗组的单个器官的缓解率均高于对照组,包括下消化道、食道、口腔、皮肤、上消化道、关节和筋膜、眼、肝脏和肺。而且,芦可替尼组患者的症状缓解率高于对照组(24.2% vs. 11.0%;P=0.0011)。根据患者报告的生活质量量表评分对比结果,第24周时芦可替尼治疗组、BAT组分别有72.6%、54.6%患者无症状或有轻度症状。3年随访结果显示,芦可替尼组的中位无失败生存期相较于BAT组更长(38.4个月 vs. 5.7个月;风险比[HR]=0.361,95% CI:0.268-0.485),12个月的无失败生存率分别为64.0%和28.8%。安全性方面,两组的3级及以上不良事件发生率、巨细胞病毒感染和再激活发生率相似,芦可替尼治疗组未观察到新的安全性事件。
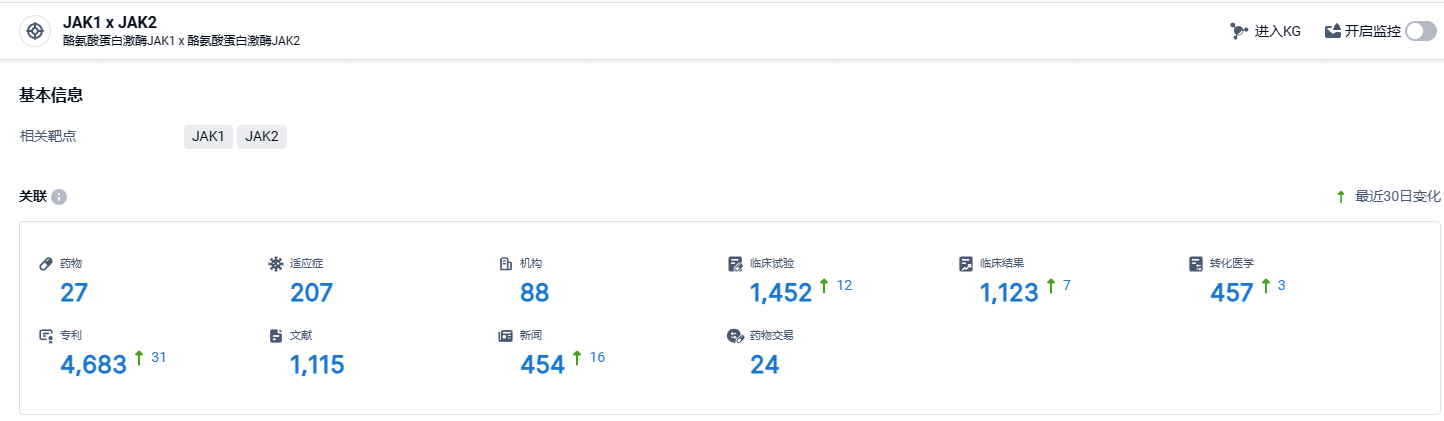
根据智慧芽新药情报库所披露的信息 (点击下方图片直达JAK1/JAK2 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年6月14日,JAK1/JAK2靶点共有在研药物27个,包含的适应症有207种,在研机构88家,涉及相关的临床试验1452件,专利多达4683件……芦可替尼在自身免疫疾病领域有着非常优秀的表现,期待该药能够造福更多患者。