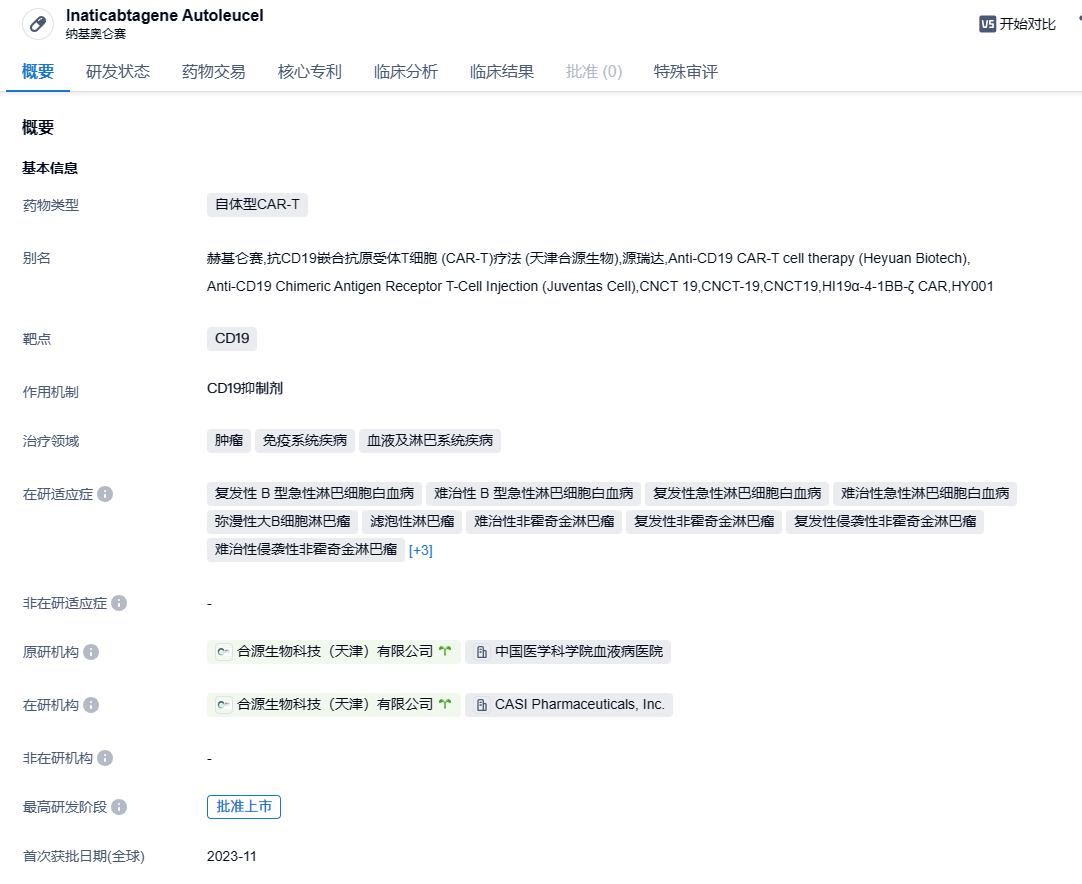
合源生物靶向CD19 CAR-T产品纳基奥仑赛在中国获批,治疗r/r B-ALL
2023年11月8日,中国国家药监局(NMPA)官网公示,合源生物递交的CAR-T产品纳基奥仑赛注射液(曾用名:赫基仑赛)的上市申请已获得批准,用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)。值得一提的是,这也是首款在中国获批上市的治疗白血病的CAR-T产品。
纳基奥仑赛(CNCT19,Inaticabtagene Autoleucel)是一款基于慢病毒载体的自体CAR-T产品,其具有全球独特的CD19 scFv(HI19a)结构和国际领先的生产制造工艺,该药物先后获得国家药品监督管理局三项新药临床试验(IND)许可,用于治疗成人复发或难治性急性淋巴细胞白血病、治疗复发或难治性侵袭性B细胞非霍奇金淋巴瘤和治疗儿童及青少年复发或难治B细胞型急性淋巴细胞白血病。值得一提的是,今年3月,美国FDA也已批准纳基奥仑赛注射液的IND申请,拟开发用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)。
根据合源生物此前发布的临床试验数据,纳基奥仑赛注射液在已开展的针对急性淋巴细胞白血病的临床研究中已治疗了超过100例中国患者,是迄今最大规模的中国患者人群CD19 CAR-T临床安全性和有效性数据积累,在关键性临床研究中展示出持久的高缓解率,其总体缓解率达82.1%,且有患者的持续缓解时间截至数据发布时最长已超过24个月,并仍在持续缓解中;除了持久的高缓解率,纳基奥仑赛注射液表现出了显著降低的CAR-T治疗相关毒性严重性,3级及以上细胞因子风暴(CRS)发生率为10.3%;3级及以上免疫效应细胞相关神经毒性综合征(ICANS)发生率为7.7%,无非预期靶向CD19 CAR-T治疗导致的不良事件发生。总体上,纳基奥仑赛注射液持久的高缓解率和安全性明显优于现有治疗手段,是治疗成人r/r B-ALL的重大突破。
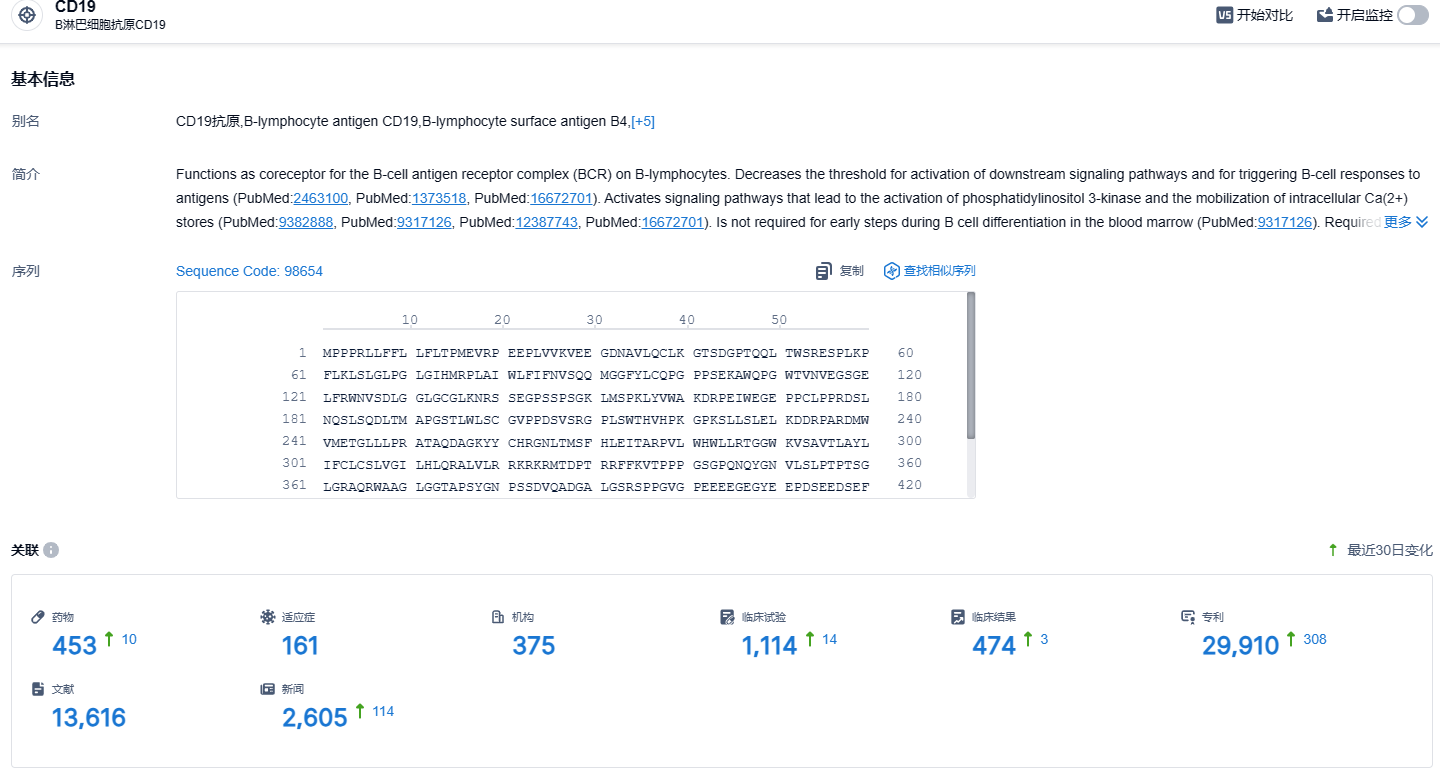
根据智慧芽新药情报库所披露的信息 (点击下方图片直达CD19 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月9日,CD19靶点共有在研药物453个,包含的适应症有161种,在研机构375家,涉及相关的临床试验1114件,专利多达29910件……纳基奥仑赛注射液作为中国第一款、全球第二款用于治疗成人急性淋巴细胞白血病的CAR-T产品填补了国内细胞疗法在这一疾病治疗领域的空白。期待纳基奥仑赛其他临床研究也能顺利进行。