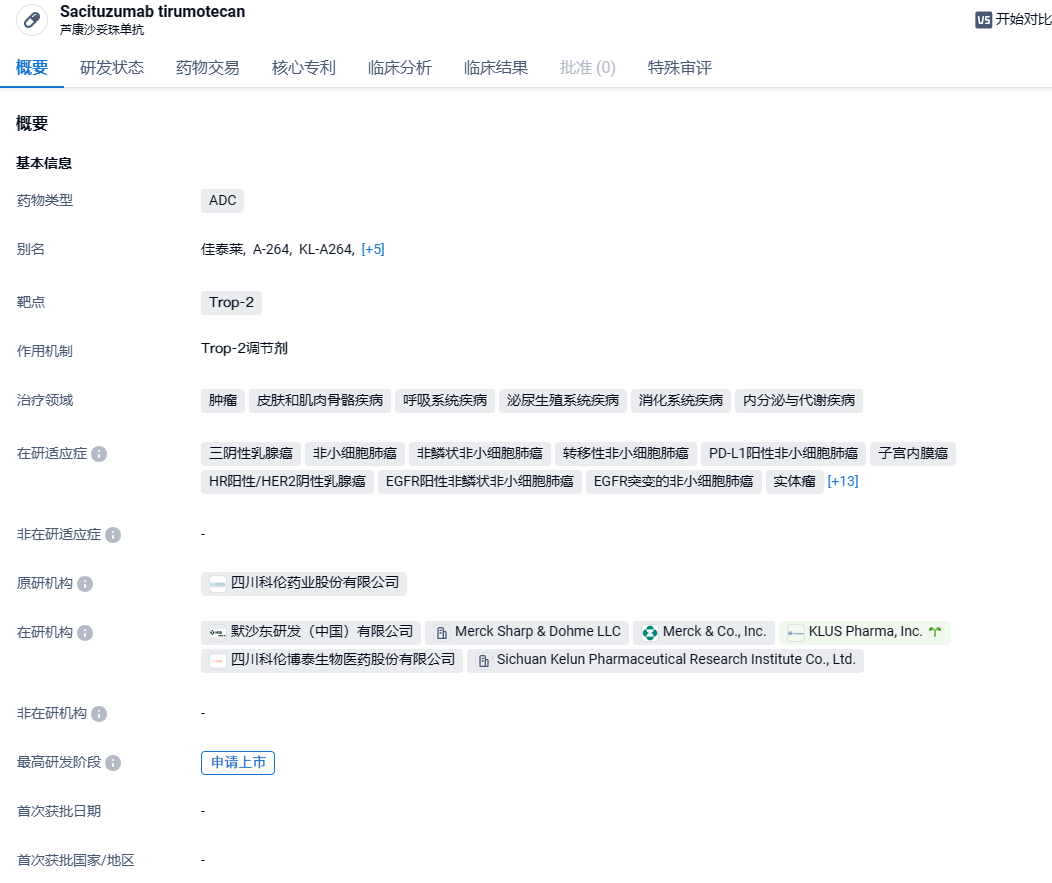
科伦博泰公布靶向TROP2 ADC疗法芦康沙妥珠单抗2期临床数据,针对胃癌
2024年4月8日,科伦博泰宣布,将在2024年美国癌症研究协会(AACR)大会上公布核心产品靶向TROP2的抗体偶联药物(ADC)芦康沙妥珠单抗(此前称SKB264/MK-2870)的两项研究结果,包括一项以口头报告形式公布的治疗晚期胃癌或胃食管交界部癌(GEJ)患者的2期研究的初步疗效和安全性结果。
芦康沙妥珠单抗是由科伦博泰拥有自主知识产权的靶向TROP2的人源化单克隆抗体、可酶促裂解的Linker和新型拓扑异构酶I抑制剂组合而成的新一代抗体偶联药物(ADC),结合了单抗对肿瘤细胞表面靶抗原的特异性和细胞毒性药物的高效性。此前,SKB264已获得国家药品监督管理局(NMPA)药品审评中心(CDE)突破性疗法认定,用于治疗局部晚期或转移性三阴乳腺癌和EGFR-TKI治疗失败的局部晚期或转移性EGFR突变非小细胞肺癌。 在国外,科伦博泰已有偿独家许可默沙东在大中华区(包括中国大陆、香港、澳门和台湾)以外开发、使用、制造及商业化SKB264(MK-2870),海外临床研究正在美国、加拿大、澳大利亚、法国、比利时和波兰有序开展或准备开展中。 多项全球多中心注册性临床研究在筹备中。
在KL264-01研究(NCT04152499)的2期扩展队列中,既往接受过治疗的不可手术切除的晚期胃/食管胃交界部腺癌患者入组并每2周接受一次5 mg/kg剂量的芦康沙妥珠单抗 (SKB264/sac- TMT)单药治疗,直至疾病进展或出现不可耐受毒性。既往接受过多线治疗的胃癌/食管胃交界部癌症患者首先入组,在队列标准修订后入组既往仅接受过一线化疗和抗PD-1/L1治疗的患者。数据截止日期为2023年11月22日。
截至数据截止日期,共有48例患者入组并至少进行了9周的随访。24例患者(50.0%)既往接受过一线治疗(2L),另外24例患者(50.0%)既往接受过二线及以上治疗(3L+)。40例患者(83.3%)既往接受过抗PD-1/L1抑制剂治疗。在41例有疗效评估的患者(在研究期间进行过至少一次扫描)中,客观缓解率(ORR)为22.0%(9例部分缓解,2例待确认),疾病控制率(DCR)为80.5%。2L和3L+患者的客观缓解率(ORR)分别为27.3%(含2例待确认)和15.8%。中位持续缓解时间(DoR)为7.5个月。在随访时间较长(中位随访时间为14.6个月)的3L+患者(24例患者,其中54.2%既往接受过至少4线治疗)中,中位无进展生存期(mPFS)为3.7个月(95% CI:2.6, 5.4),中位总生存期(mOS)为7.6个月(95% CI:5.3, 15.5)。
最常见的≥3级TRAE为贫血(20.8%)、中性粒细胞计数降低(18.8%)、白细胞计数降低(12.5%)以及中性粒细胞减少症(6.3%)。没有因TRAE导致的停药或死亡,没有观察到神经毒性、药物相关的间质性肺病或非感染性肺炎的发生。
目前正在计划开展一项芦康沙妥珠单抗(SKB264/sac- TMT)单药治疗对比标准治疗(SOC)化疗用于3L+ 胃癌或食管胃交界部腺癌患者的全球3期研究。
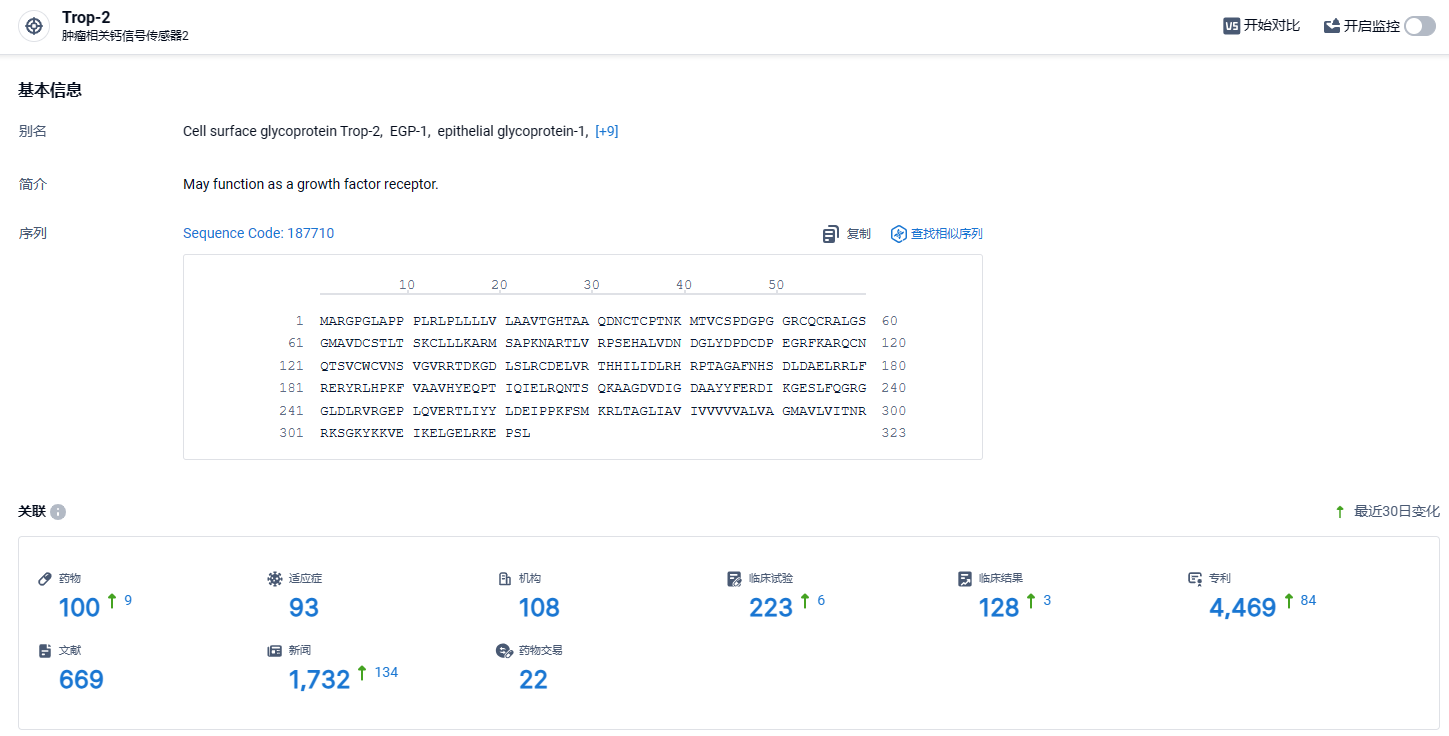
根据智慧芽新药情报库所披露的信息 (点击下方图片直达TROP2 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年4月10日,TROP2 靶点共有在研药物100个,包含的适应症有93种,在研机构108家,涉及相关的临床试验223件,专利多达4469件……SKB264是科伦博泰拥有自主知识产权的核心产品之一,该药在乳腺癌、胃癌、肺癌等领域展现出优秀的治疗潜力,期待该药早日成功上市。