康诺亚IL-4Rα单抗一项III期研究成功,预计明年慢性鼻窦炎伴鼻息肉上市申请
2023年12月27日,康诺亚宣布其1类新药CM310(司普奇拜单抗)治疗慢性鼻窦炎伴鼻息肉的III期临床研究(CM310-102208,登记号:CTR20221480)已完成双盲治疗期数据揭盲及初步统计分析,临床数据达到主要终点。康诺亚计划将于2024年内向国家药品监督管理局(NMPA)药品评审中心(CDE)递交CM310治疗慢性鼻窦炎伴鼻息肉的上市许可申请。
司普奇拜单抗注射液(CM310) 是一种针对IL-4Rα的高效、人源化拮抗性抗体,其通过靶向IL-4Rα,双重阻断IL-4和IL-13 对IL-4Rα 的活化,从而阻断诱导II 型炎症的信号传导途径,治疗与II 型炎症相关的多种疾病,如II 型过敏性疾病,具体包括特应性皮炎、哮喘、慢性鼻窦炎及嗜酸性食管炎等。2023年12 月 7 日,据 CDE 官网显示,康诺亚递交的司普奇拜单抗上市申请获受理,适应症为用于治疗外用药控制不佳或不适合外用药治疗的成人中重度特应性皮炎(受理号:CXSS2300090),并纳入优先审评审批程序。
CM310-102208是一项多中心、随机、双盲、安慰剂对照的III期临床研究,主要用于确证CM310在治疗慢性鼻窦炎伴鼻息肉患者中的有效性及安全性。本次研究共纳入了180例受试者,以1:1的随机比例分别接受CM310 300mg和安慰剂治疗,每2周一次,双盲期共治疗12次,共同主要终点是治疗24周鼻息肉评分(NPS)及鼻塞评分(NCS)较基线变化。研究结果显示III期临床试验数据结果积极,共同主要终点均完全达标,CM310组皆优于安慰剂组,具备高度显著的统计学差异(P值均<0.0001),且安全性良好。
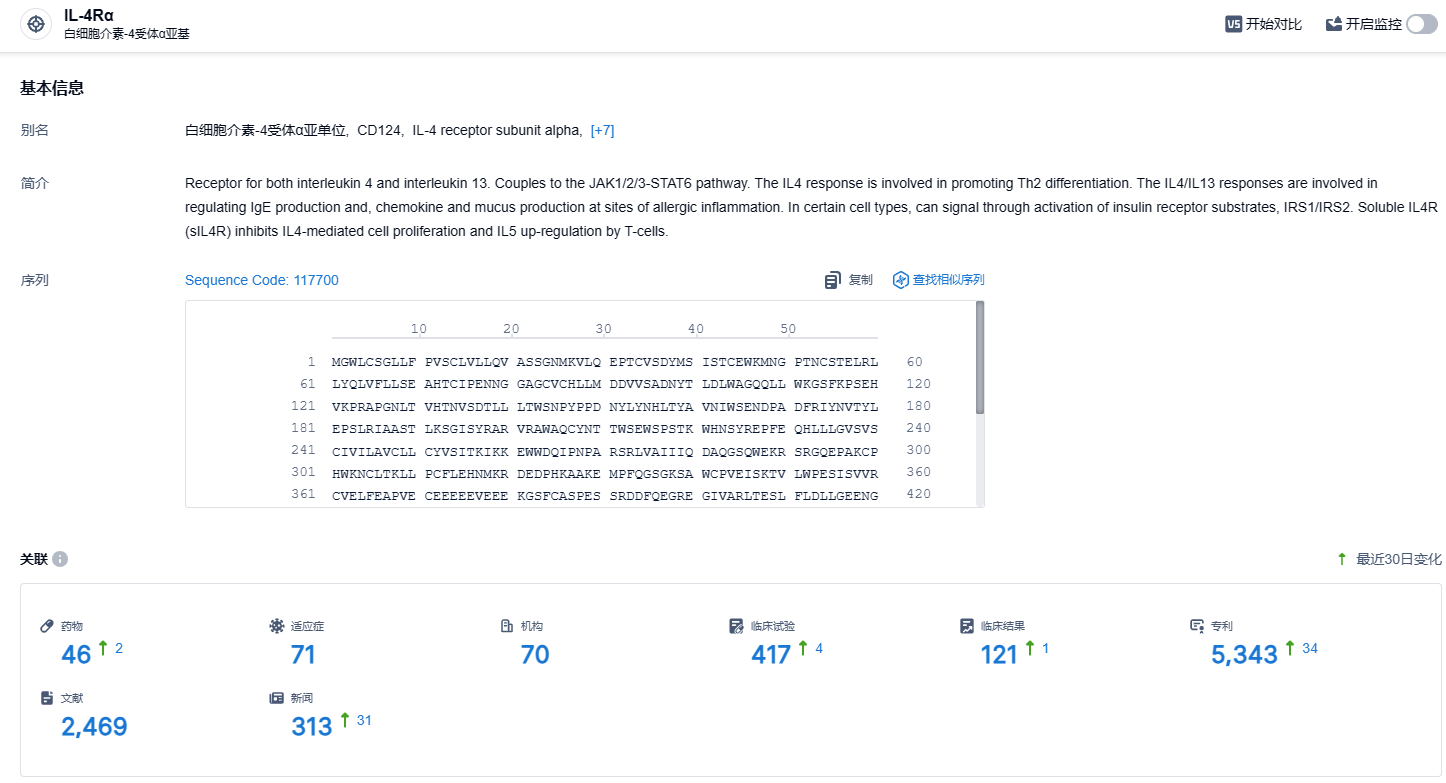
根据智慧芽新药情报库所披露的信息 (点击下方图片直达IL-4Rα靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年12月28日,IL-4Rα靶点共有在研药物46个,包含的适应症有71种,在研机构70家,涉及相关的临床试验417件,专利多达5343件……当前全球仅有 1 款 IL-4R 抗体获批上市,为赛诺菲与再生元合作开发的度普利尤单抗(Dupilumab)。Dupixent 在2022 年达到 87.31 亿美元年销售额,在全球药品销售额 TOP 榜上稳坐前列,今年大概率突破百亿美元。期待司普奇拜单抗早日获批,在IL-4Rα靶点赛道占据一席之地。