Kowa Company旗下PPARα调节剂佩玛贝特在中国申报上市,治疗高血脂症
2023年10月19日,中国国家药品监督管理局药品审评中心(CDE)官网公示,Kowa Company递交了5.1类新药佩玛贝特片的上市申请并获得受理。
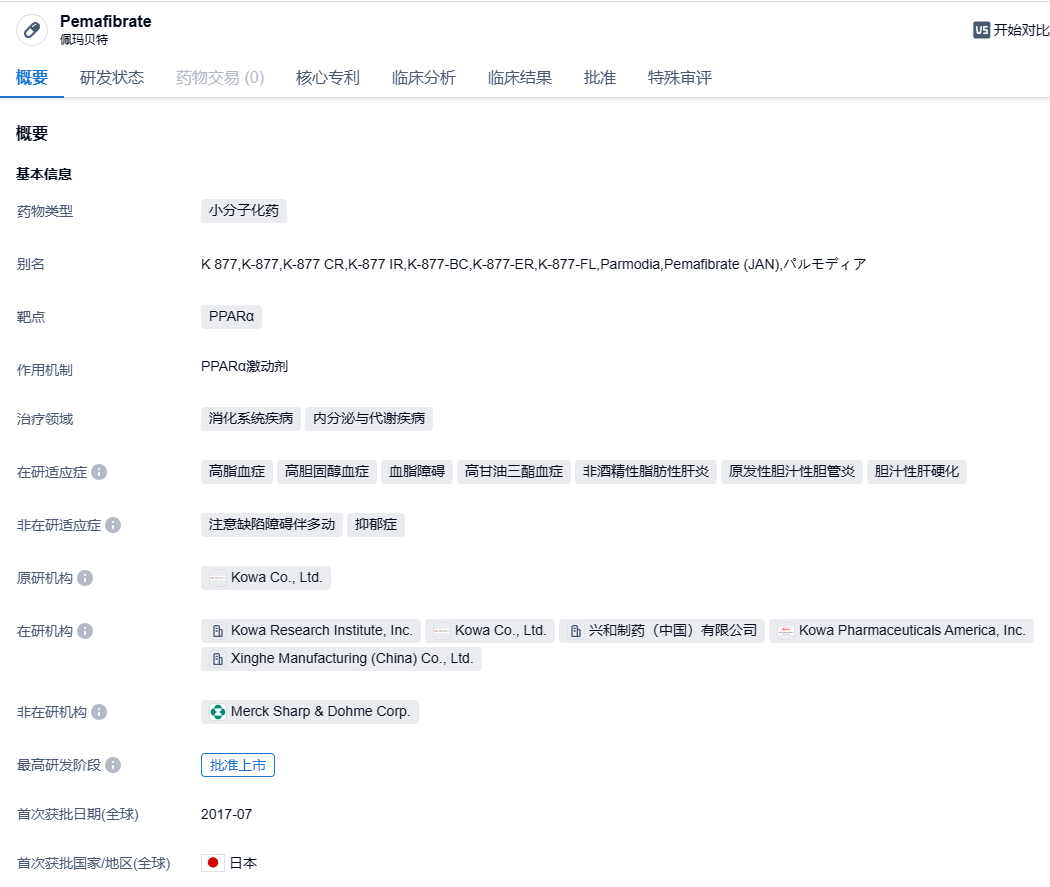
佩玛贝特(Pemafibrate)是Kowa Company开发的一种新型、高选择性PPARα调节剂。它通过与PPARα结合并调节参与脂质代谢的基因的表达,从而降低血浆甘油三酯(TG)水平和增加高密度脂蛋白胆固醇(HDL-C)水平。且相关研究结果显示了佩玛贝特有效的空腹血清TG降低作用、HDL-C增加作用及其持续的长期作用。该药此前已在日本被批准用于治疗高脂血症(包括家族性高脂血症)。2017年7月,佩玛贝特普通片获日本厚生劳动省全球首次批准上市许可。2023年6月26日,佩玛贝特的新剂型缓释片获日本PMDA全球首次批准上市许可,用于高脂血症(含家族性高脂血症)。相比佩玛贝特片的每日2次,缓释片每日仅需服用1次。佩玛贝特是全球首个获批上市许可的过氧化物酶体增殖物激活受体α(PPARα)调节剂,能够通过调节肝脏脂质代谢来改善血清甘油三酯低等问题,安全性优于其他贝特类降脂药。据ClinicalTrials临床试验登记网站,佩玛贝特除高脂血症外,另有3个适应症(非酒精性脂肪肝、2型糖尿病、高胆固醇血症)处于临床研究阶段。
2022年11月,《新英格兰医学杂志》(NEJM)在线发表了佩玛贝特在PROMINENT试验中的结果。试验纳入的患者均合并2型糖尿病、TG轻中度升高(200~499mg/dl)、HDL-C水平偏低(≤40mg/dl),且均接受他汀类药物治疗。结果显示,截至4个月时,佩玛贝特与安慰剂相比将中位TG水平降低26.2%,并且对HDL-C等其他血脂参数也有益处,但并未降低心梗、中风或心血管疾病死亡复合事件风险。
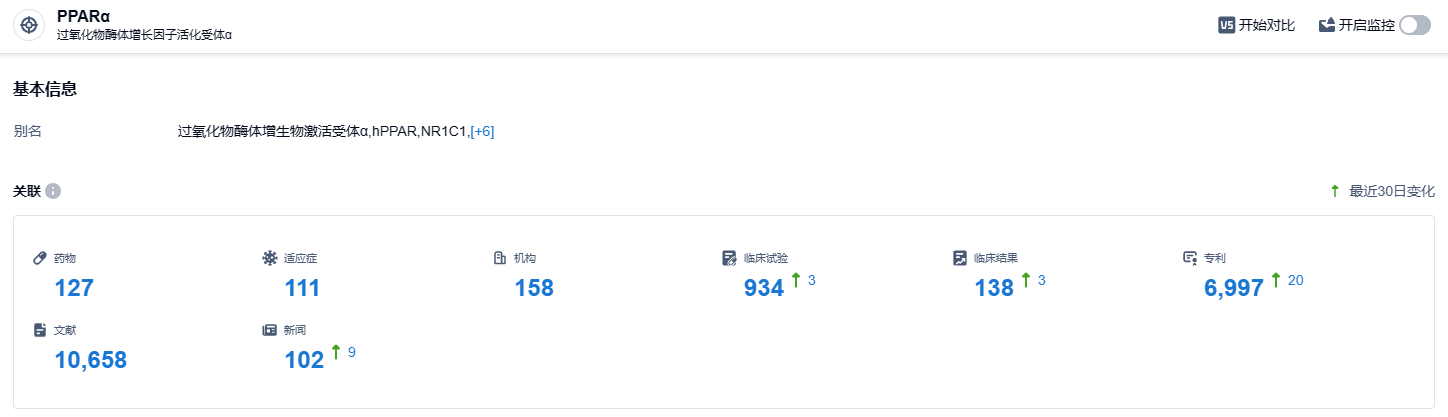
根据智慧芽新药情报库所披露的信息 (点击下方图片直达PPARα靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年10月20日,PPARα靶点共有在研药物127个,包含的适应症有111种,在研机构158家,涉及相关的临床试验934件,专利多达6997件……目前佩玛贝特治疗血脂异常的适应症已进展至临床3期,并已在中国递交上市申请。而除了治疗血脂异常的适应症以外,该产品也在积极拓展其他的适应症,其中,治疗原发性胆汁性胆管炎的适应症已进展至临床2期阶段。期待佩玛贝特能够早日上市,为国内患者带来新的治疗选择。