创胜集团抗CLDN18.2抗体Osemitamab在美国获批3期临床,治疗胃癌
近日,创胜集团宣布已被美国FDA批准开展全球3期关键性试验TranStar 301,以期在HER2阴性、CLDN18.2表达局部晚期或转移性胃癌或胃食管结合部腺癌(G/GEJ)患者中,探索抗CLDN18.2单抗Osemitamab(TST001)联合抗PD-1抗体纳武利尤单抗及化疗作为一线治疗的疗效和安全性。此前,这项全球试验已获得中国国家药品监督管理局药品审评中心(CDE)和韩国食品药品安全部(MFDS)批准开展。
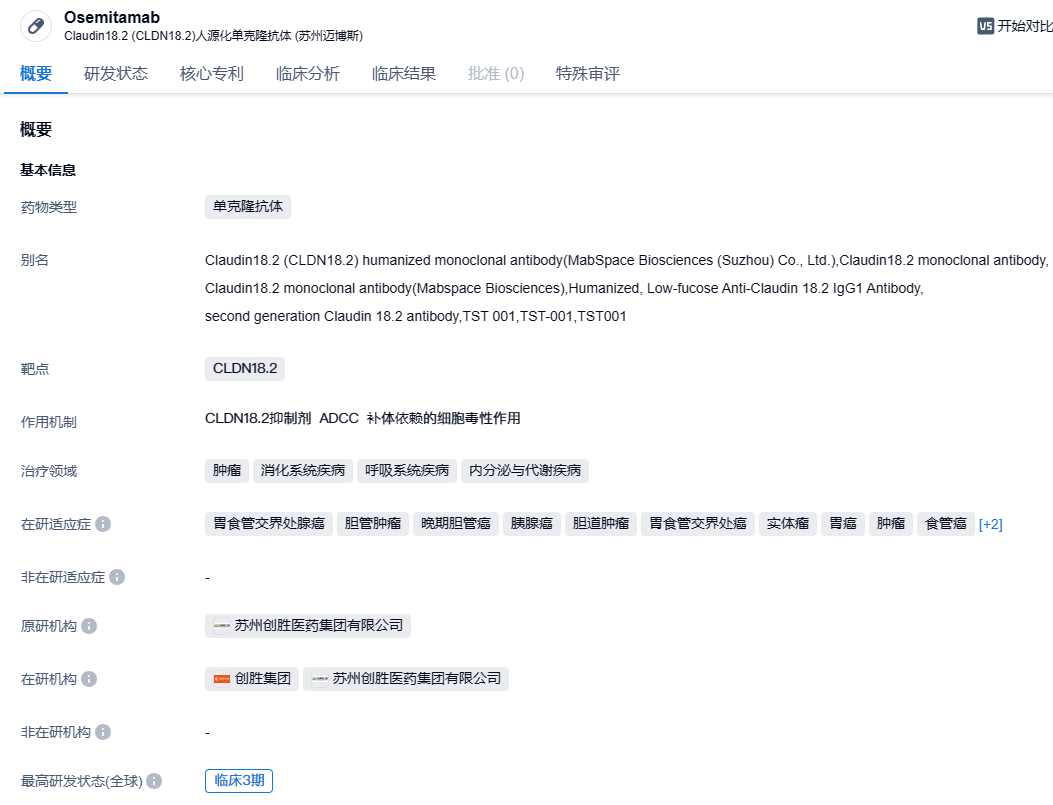
Osemitamab (TST001) 是创胜集团开发的一种高亲和力的靶向Claudin18.2的人源化单克隆抗体,具有增强的抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)活性,在异种移植试验中显示出强大的抗肿瘤活性。Osemitamab (TST001) 通过ADCC和CDC机制杀死表达Claudin18.2的肿瘤细胞,利用先进的生物加工技术,Osemitamab (TST001) 的岩藻糖含量在生产过程中大大降低,进一步增强了Osemitamab (TST001) 的NK细胞介导的ADCC活性。
此前,创胜集团于2023年ASCO年会和2023年ESMO GI年会公布Osemitamab(TST001) 联合CAPOX作为胃或胃食管结合部腺癌一线治疗的疗效数据。64 例CLDN18.2 阳性患者(定义为:用LDT方法≥10%肿瘤细胞的CLDN18.2 IHC膜染色强度≥1+,筛选出约55%的患者)接受了治疗,其中49例接受了6mg/kg的剂量治疗。数据显示,所有剂量组中,预计中位无进展生存期为9.5个月,与所有CLDN18.2表达水平一致,预计中位缓解持续时间为9.9个月。
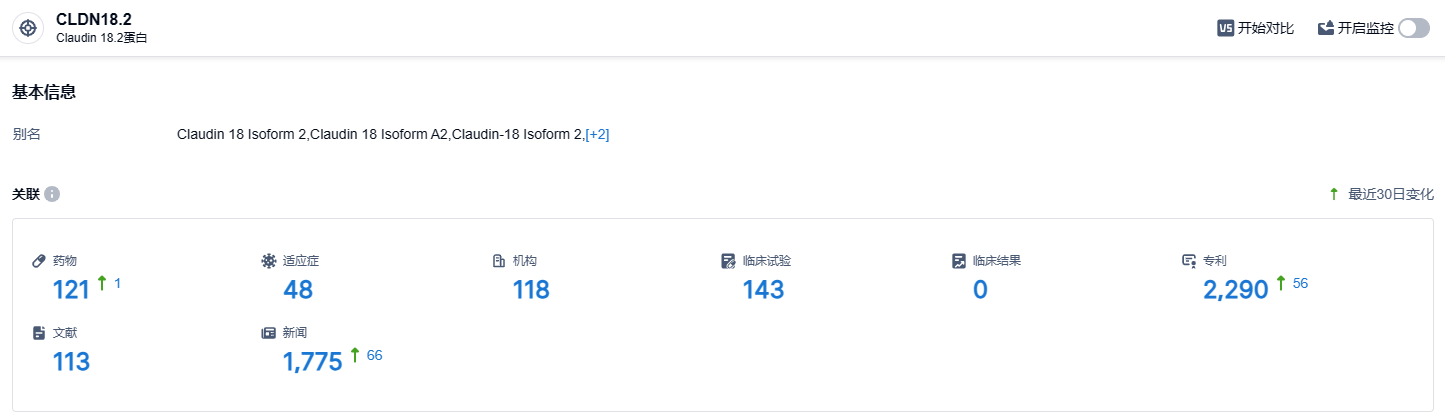
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 Claudin18.2靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年10月8日,CLDN18.2靶点共有在研药物121个,包含的适应症有48种,在研机构118家,涉及相关的临床试验143件,专利多达2290件……CLDN18.2靶点研发热度非常高,在国内外均有不少药企研发,期待国产CLDN18.2靶点新药能够尽早上市,与外企新药同台竞技。