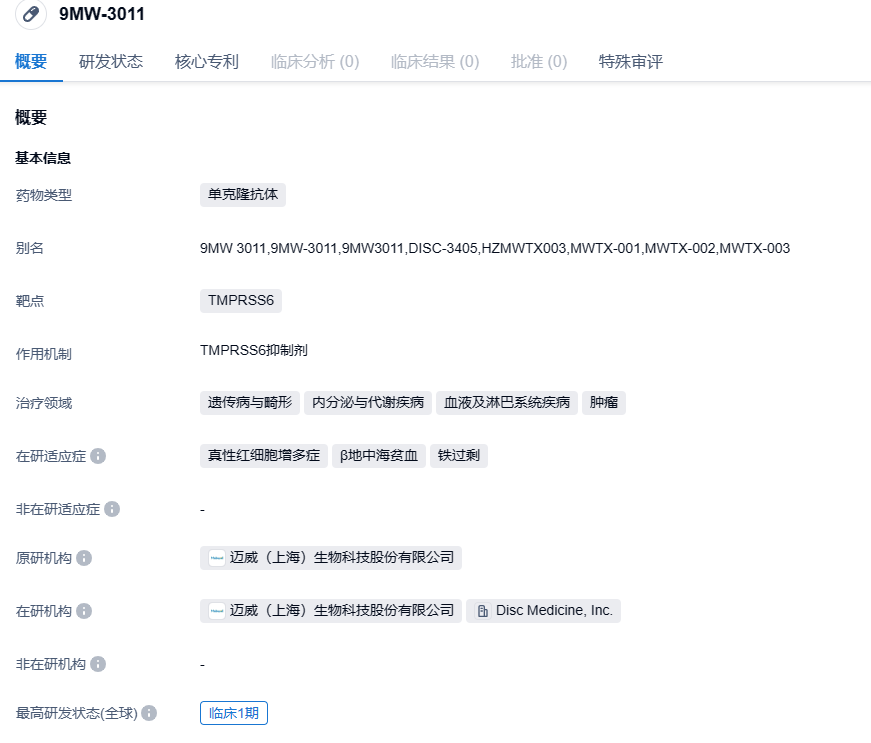
迈威生物TMPRSS6抗体9MW3011获FDA快速通道认定,治疗真性红细胞增多症
2023年9月21日,迈威生物宣布美国FDA授予其铁稳态大分子调节药物9MW3011(MWTX-003/DISC-3405)快速通道认定 (FTD),用于治疗真性红细胞增多症 (PV)。
9MW3011是迈威生物位于美国的 San Diego 创新研发中心自主研发的抗TMPRSS6单克隆抗体,为治疗用生物制品 1 类。其靶点主要表达在肝细胞膜表面,9MW3011 可通过特异性结合,上调肝细胞表达铁调素 (Hepcidin) 的水平,抑制铁的吸收和释放,降低血清铁水平,从而调节体内的铁稳态。9MW3011 适应症拟包括多种在全球不同地区被列为罕见病的疾病,如 β-地中海贫血、真性红细胞增多症等与铁稳态相关的疾病。目前,相关适应症领域尚无成熟有效的治疗方法或药物,因此,9MW3011 有望在未来获得孤儿药资格,并成为全球范围内首个调节体内铁稳态的大分子药物。
迈威生物已授予DISC MEDICINE除大中华区和东南亚以外所有区域内独家开发、生产和商业化以及以其他方式开发9MW3011的权利。迈威生物可获得合计最高达4.125亿美元的首付款及里程碑付款,以及产品上市后基于净销售额的特许权使用费。9MW3011已在中美获批开展临床试验,并于今年3月在国内完成首例受试者给药。该研究(登记号 CTR20230046)是一项在中国健康受试者中单次静脉输注9MW3011的单中心、随机、双盲、安慰剂对照、剂量递增设计的安全性,耐受性,药代动力学,药效学及免疫原性 I 期临床研究。
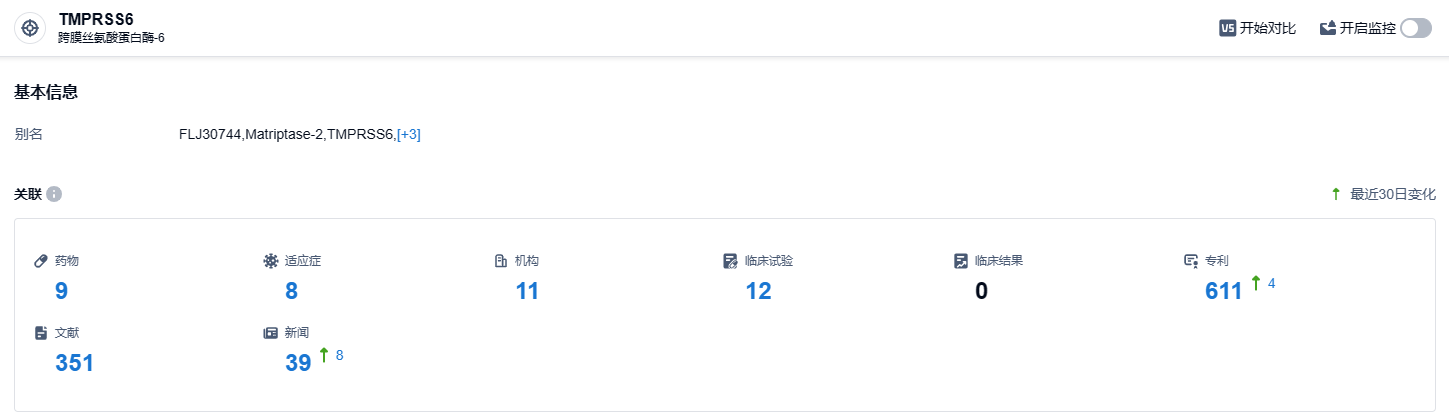
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 TMPRSS6 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年8月23日,TMPRSS6 靶点共有在研药物9个,包含的适应症有8种,在研机构11家,涉及相关的临床试验12件,专利多达611件……FDA 的快速通道认定 (FTD) 旨在加速用于治疗严重疾病的药物的开发与审查,进而加快这些药物的上市进程,获得快速通道认定的治疗药物有望后续在符合相关标准条件时获得优先审查和加速批准。期待9MW3011的后续表现。