治疗成人结节性痒疹,赛诺菲/再生元「度普利尤单抗」在中国获批新适应症
2023年9月22日,中国国家药监局(NMPA)官网最新公示,由赛诺菲(Sanofi)和再生元(Regeneron)联合开发的度普利尤单抗注射液新适应症上市申请已获得批准。根据中国国家药监局药品审评中心(CDE)官网优先审评公示,该产品此次获批用于治疗成人结节性痒疹。该药是美国首个专门用于治疗结节性痒疹的药物。
度普利尤单抗是是赛诺菲与再生元合作开发的一款人源性单克隆抗体,靶向IL-4Rα。通过结合 IL-4Rα,度普利尤单抗可同时阻断IL-4 和IL-13信号通路,IL-4和IL-13 被认为是特应性皮炎持续性炎症的主要驱动因子。2017 年 3 月,度普利尤单抗获FDA批准成为首个用于治疗成人中重度特应性皮炎的靶向生物药,商品名为 Dupixent®。度普利尤单抗在国内首次上市批准时间为 2020年6月,用于治疗成人中重度特应性皮炎。随后,又陆续申报两项适应症,分别针对 12 岁及以上的中重度特应性皮炎患者,以及6~12岁的中重度特应性皮炎患者,均以儿童用药的理由纳入优先审评审批并取得批准。
此次批准是基于两项随机、双盲、安慰剂对照的III期PRIME和PRIME2研究的积极数据,旨在评估Dupixent用于治疗结节性痒疹成人患者的疗效和安全性。度普利尤单抗治疗成人结节性痒疹的疗效已在两项双盲、安慰剂对照3期试验(PRIME和PRIME2)中取得积极结果,试验共计在311例患者中评估了度普利尤单抗的疗效和安全性。两项试验均达到了主要和关键次要终点,与安慰剂相比,度普利尤单抗显著减轻了患者瘙痒和皮肤病变。
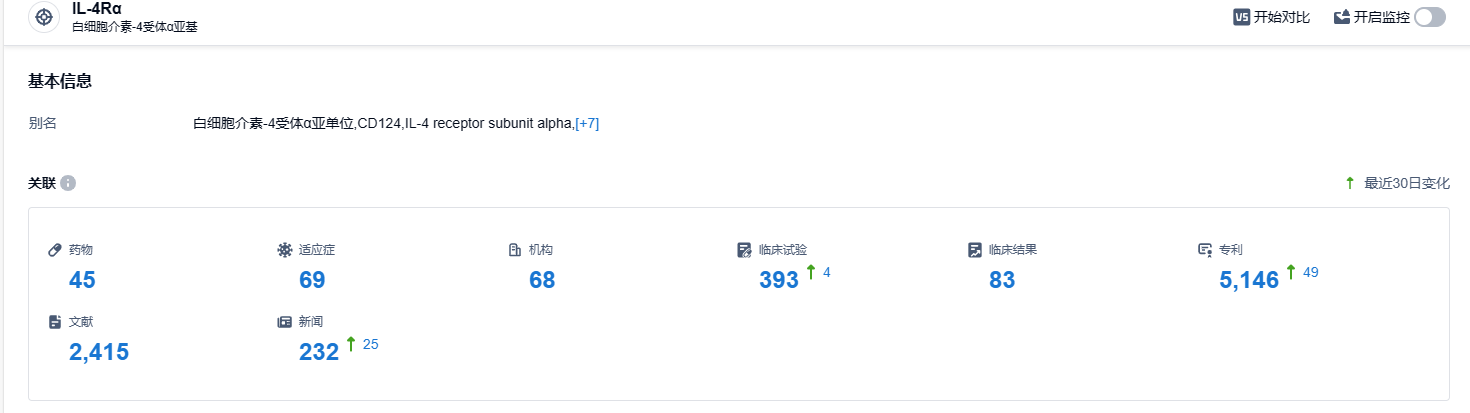
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 IL-4Rα 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年9月22日,IL-4Rα靶点共有在研药物45个,包含的适应症有69种,在研机构68家,涉及相关的临床试验393件,专利多达5446件……度普利尤单抗是第一款领域横跨皮肤科、呼吸科、变态反应用药的生物制剂,优秀的临床数据,使得其具有非常强的市场潜力。自2017 年上市以来度普利尤单抗全球销售额增长迅速,至2022 年达到82.93 亿欧元。期待其在国内的市场表现。