Kazia Therapeutics脑胶质瘤新药Paxalisib II/III期临床成功,先声药业拥有中国权益
2024年7月10日,Kazia Therapeutics宣布,旗下Paxalisib对比标准治疗(SOC)用于胶质母细胞瘤的II/III期GBM-AGILE研究取得了积极结果,达到了总生存期(OS)这一主要终点,非甲基化的新发胶质母细胞瘤(NDU)患者的总生存期有临床意义的改善。
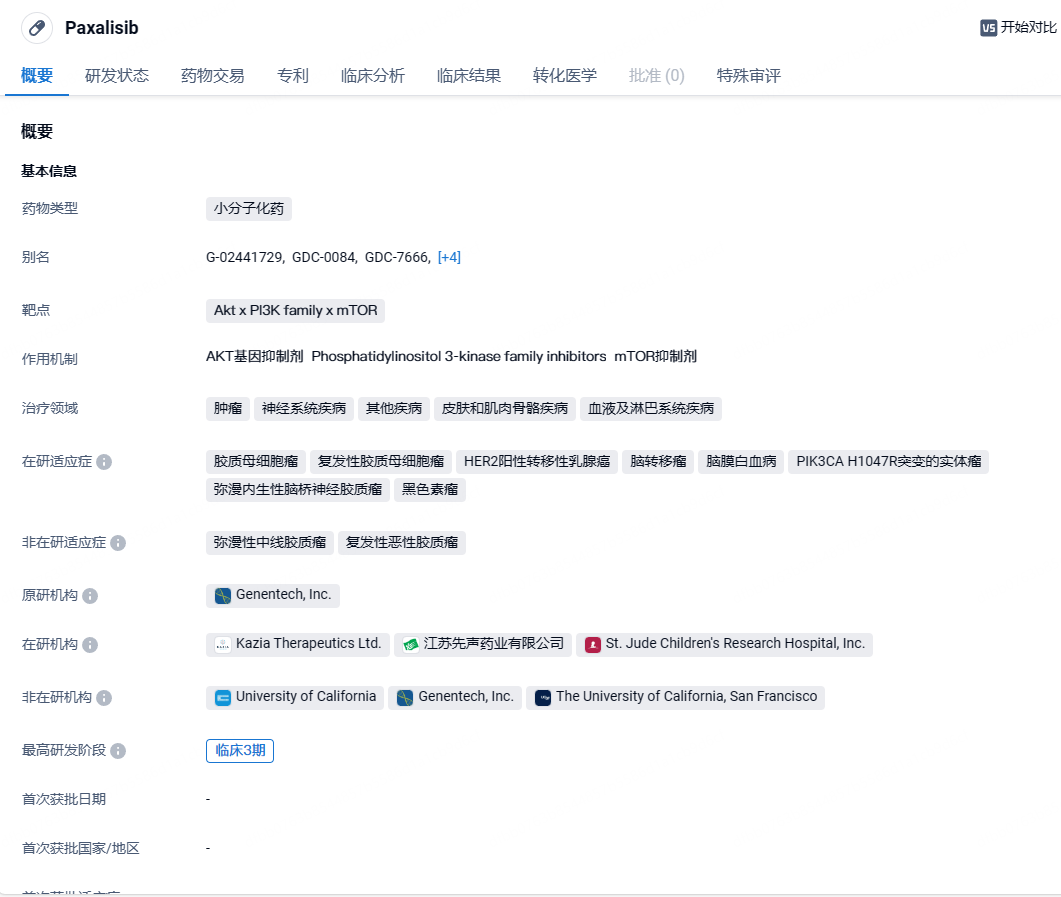
paxalisib是Kazia的先导候选药物,这是一种能穿过血脑屏障的PI3K/AKT/mTOR通路小分子抑制剂,于2016年底从罗氏旗下基因泰克获得授权,于2018年进入II期临床试验。在2018年2月,FDA还授予了paxalisib治疗胶质母细胞瘤的孤儿药资格(ODD),这是最常见和最具侵袭性的原发性脑癌。2021年3月,先声药业与Kazia Therapeutics签署独家许可协议,引进Paxalisib在大中华地区(中国大陆、香港、澳门和台湾)所有适应症的开发和商业化的权益。根据协议约定,先声将负责Paxalisib在大中华地区的开发、注册及商业化,Kazia Therapeutics将获得首付、里程碑付款及在中国的销售分成。
初步分析显示,Paxalisib组NDU患者(n=54)的中位OS为14.77个月,而标准治疗组中位OS为13.84个月。在预先指定的二次分析中,Paxalisib组(n=54)中位OS延长至15.54个月,而对照组(n=46)则减至11.89个月;同时,预先指定的敏感性分析也显示出相似的中位OS差异,两组分别为15.54个月、11.70个月。在该研究中,Paxalisib耐受性良好,未发现新的安全信号。此外,研究还显示,在复发病人中,Paxalisib并未展现出优效性,患者中位OS为8.05个月(n=100),而对照组患者9.69个月(n=113)。基于这项研究的结果,Kazia表示将与FDA讨论是否合适加速批准Paxalisib上市。
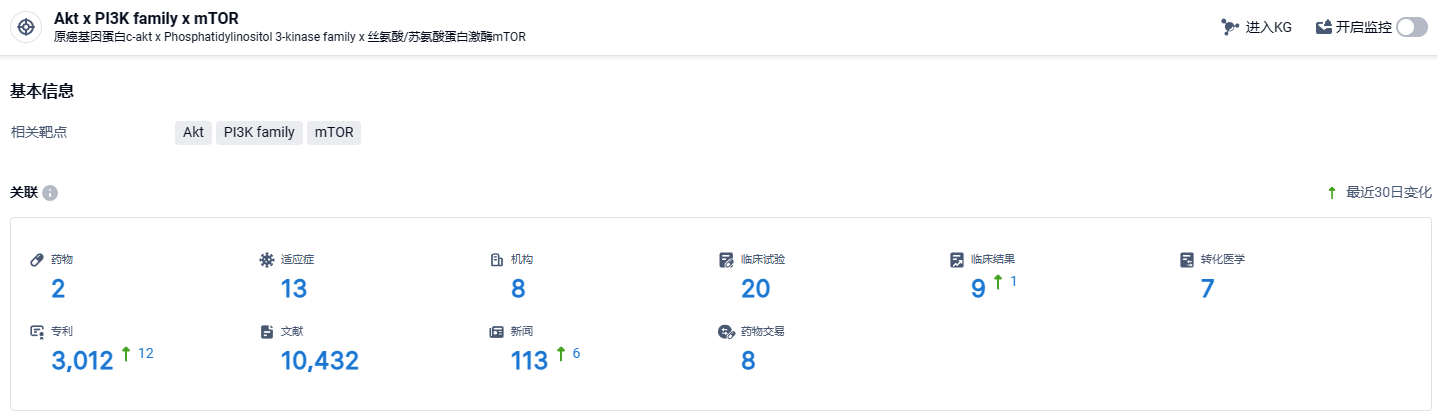
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达PI3K/AKT/mTOR通靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年7月12日,PI3K/AKT/mTOR通靶点共有在研药物2个,包含的适应症有13种,在研机构8家,涉及相关的临床试验20件,专利多达3012件……数据显示,Paxalisib可能有助于增强脑转移肿瘤的放疗效果。期待这款疗法能够获得更好的试验结果,造福更多患者。