荣昌生物BLyS/APRIL融合蛋白泰它西普在美Ⅲ期临床首例患者入组,治疗重症肌无力
8月5日,荣昌生物宣布其自主研发的BLyS/APRIL双靶点融合蛋白创新药泰它西普用于治疗全身型重症肌无力(gMG)的全球多中心Ⅲ期临床研究已于近日顺利实现美国首例患者入组。这一里程碑事件标志着泰它西普在全球范围内的临床研究迈出了重要一步,将为全球重症肌无力患者带来新的希望。
泰它西普是由荣昌生物自主研发的用于治疗自免疾病的新型融合蛋白,由人跨膜激活剂及钙调亲环素配体相互作用因子(TACI)受体的胞外域以及人免疫球蛋白G(IgG)的可结晶片段(Fc)域构成。泰它西普能够同时抑制APRIL x BAFF,得以有效降低 B 细胞介导的自身免疫应答,自身免疫应答与多种自身免疫性疾病有关。2021年3月9日,中国NMPA批准泰它西普附条件上市,用于治疗活动性、自身抗体阳性系统性红斑狼疮(SLE)的成人患者。2022年10月,泰它西普获美国FDA颁发的针对重症肌无力治疗的孤儿药资格认定。目前泰它西普SLE适应症正在美国开展3期临床试验,预计2024年完成。2024年4月2日,荣昌生物宣布,美国FDA授予其泰它西普用于治疗干燥综合征的快速通道资格。2023年底,该适应症全球多中心3期临床已获FDA批准。
2023年9月7日,荣昌生物注射用泰它西普的新适应症上市申请获CDE受理,用于治疗类风湿性关节炎(RA)。2024年7月16日,泰它西普(RC18,商品名:泰爱®)获得中国国家药品监督管理局(NMPA)批准,新增类风湿关节炎适应症:与甲氨蝶呤联合,用于对甲氨蝶呤疗效不佳的中重度活动性类风湿关节炎成人患者。这是泰它西普继系统性红斑狼疮后,在中国获批的第2个适应症。
此前,泰它西普重症肌无力适应症获美国食品和药品管理局(FDA)孤儿药和快速通道资格认定,获中国国家药品监督管理局(NMPA)突破性疗法认定。目前,重症肌无力适应症的国内Ⅲ期临床试验已经基本完成,近期将有结果读出。此项全球多中心Ⅲ期临床为随机、双盲、安慰剂对照的研究,旨在评价泰它西普治疗全身型重症肌无力(gMG)患者的有效性和安全性,计划招募来自全球多个国家和地区的180名患者。重症肌无力(MG)是一种罕见的、慢性自身免疫性疾病,会导致神经肌肉接头传递受损,可不同程度影响眼球运动、吞咽、言语、活动和呼吸功能。根据弗若斯特沙利文报告,全球重症肌无力患者人数预计2025年达到114.60万,其中美国患者人数约为6.95万,中国患者人数约为21.67万。目前,针对重症肌无力的主要治疗方法包括胆碱酯酶抑制剂、糖皮质激素以及免疫抑制剂,缺乏有效的精准靶向治疗手段,导致部分患者因药物疗效、耐受性或使用禁忌等问题无法充分有效地控制病情,存在大量未被满足的临床需求。
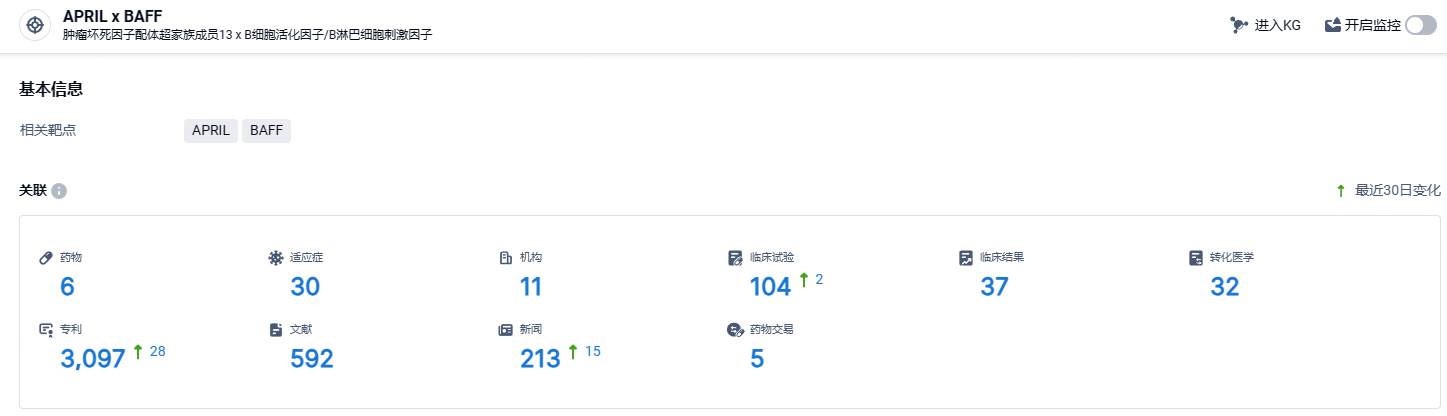
根据智慧芽新药情报库所披露的信息 (点击下方图片直达APRIL x BAFF靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年8月6日,APRIL x BAFF靶点共有在研药物6个,包含的适应症有30种,在研机构11家,涉及相关的临床试验104件,专利多达3097件……除SLE和RA之外,泰它西普用于治疗IgA肾病、视神经脊髓炎谱系疾病、原发性干燥综合征、重症肌无力、多发性硬化等适应症的Ⅲ期临床研究正在进行,展示了其在B细胞相关疾病治疗中的广泛前景。期待泰它西普能够在美国获批上市,展现国产生物药的风采。