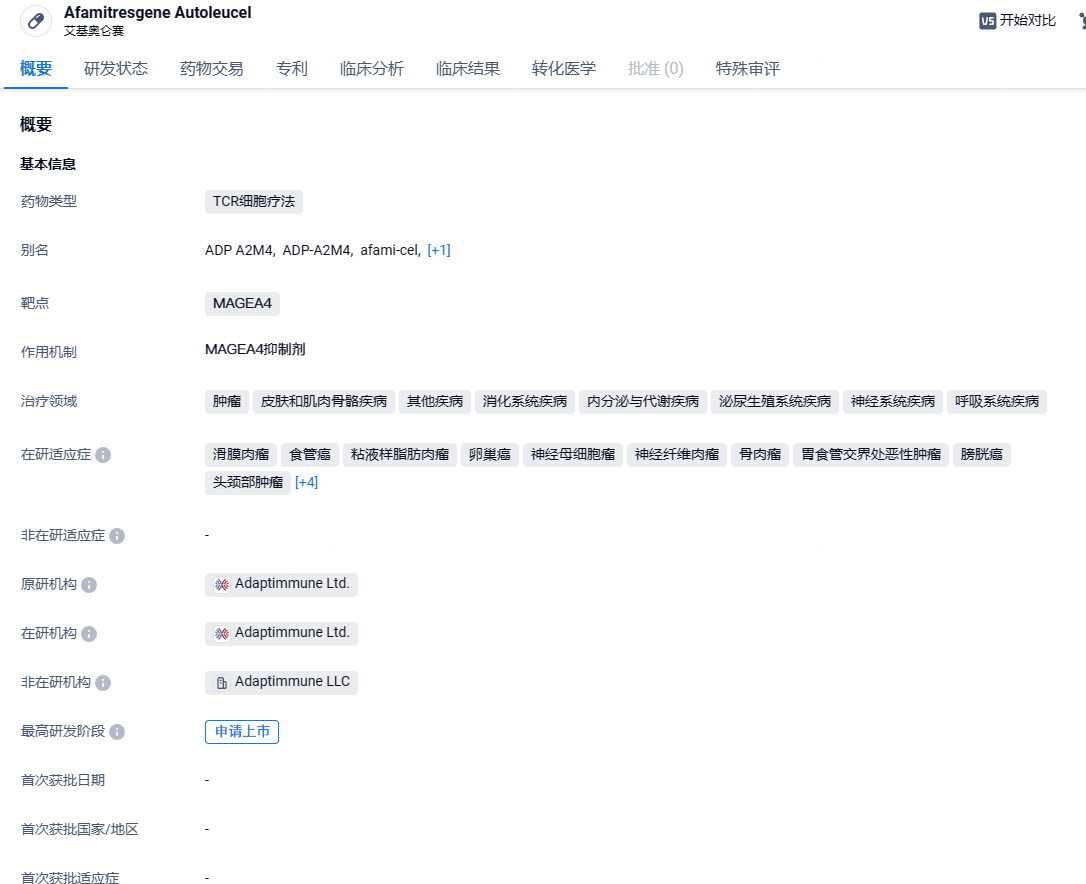
全球首款!Adaptimune旗下TCR-T细胞疗法TECELRA获批上市,用于治疗滑膜肉瘤
8 月 1 日,Adaptimune Therapeutics宣布,美国 FDA 加速批准 TECELRA® (Afamitrisgene autoleucel,Afami-cel) 上市,用于治疗患有不可切除或转移性滑膜肉瘤的成人患者,这些患者之前接受过化疗,HLA-A*02:01P、-A*02:02P、-A*02:03P 或 -A*02:06P 呈阳性,并且其肿瘤表达 MAGE-A4 抗原。值得一提的是,TECELRA 不仅是全球首个获批上市的实体瘤癌症 T 细胞疗法,也是全球首款获批上市的 TCR-T 细胞疗法。
Afami-cel是一种针对MAGEA4癌症靶点的工程化T细胞受体(TCR)T细胞疗法,被设计作为一种用于晚期滑膜肉瘤的一次性疗法。此前,美国FDA已授予其治疗软组织肉瘤的孤儿药资格和治疗滑膜肉瘤的再生医学先进疗法认定。目前,手术是滑膜肉瘤的首选治疗方法,有些病人会在手术前后接受放射治疗。如果获得批准,afami-cel将为该患者群体提供具有更高生活质量的替代治疗。2024年2月,Adaptimune Therapeutics公司宣布,美国FDA已接受其在研工程化TCR-T疗法afami-cel的生物制品许可申请(BLA),并授予其优先审评资格。该申请的PDUFA日期为2024年8月4日。此项批准为被诊断患有这种肉瘤的患者提供了新的选择。
ECELRA 的获批是基于 SPEARHEAD-1(队列 1)试验的结果,该试验纳入了 44 名患者。主要疗效结果是独立审查委员会确定的总缓解率 (ORR)。数据显示,患者的 ORR 为 43%,完全缓解率为 4.5%。中位缓解持续时间为 6 个月(95% CI:4.6,未达到)。在对治疗有反应的患者中,39% 的患者缓解持续时间为 12 个月或更长时间。
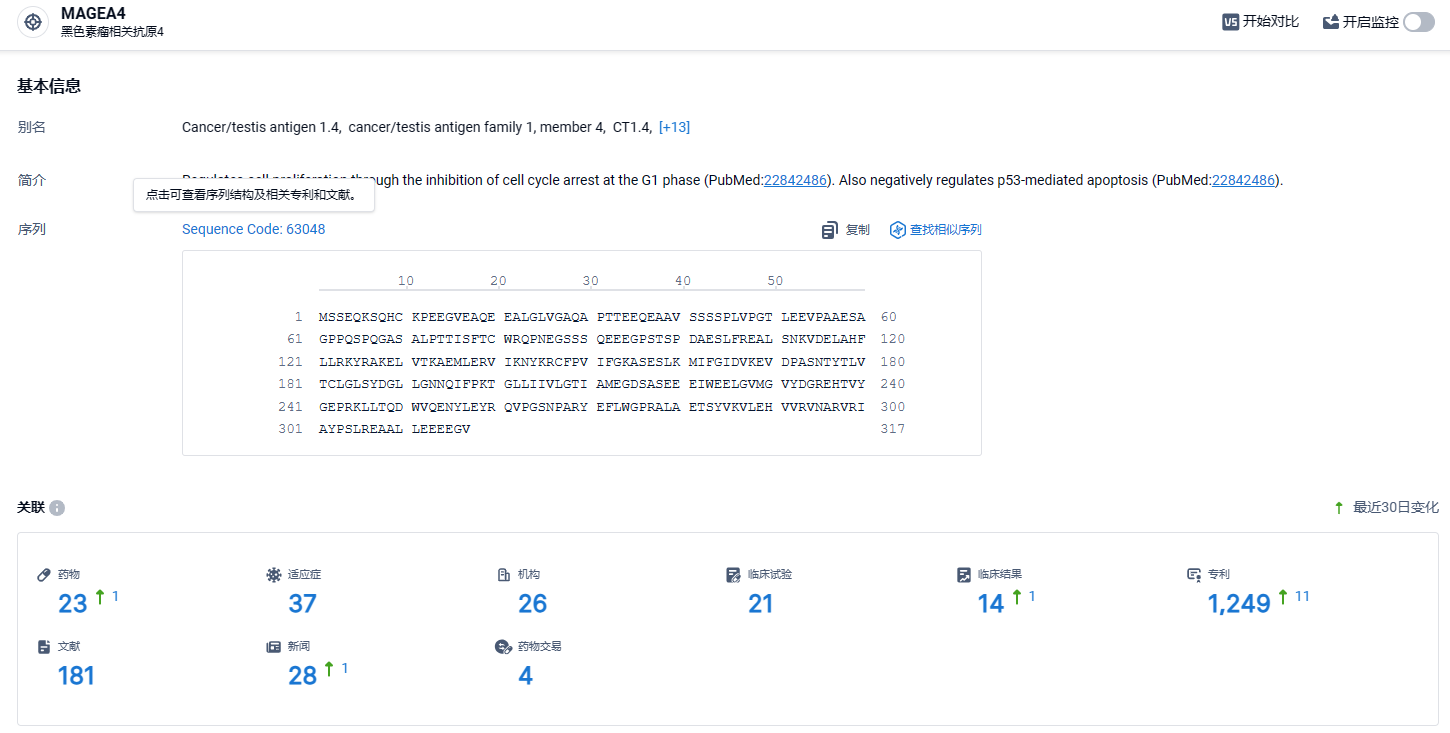
根据智慧芽新药情报库所披露的信息 (点击下方图片直达MAGEA4靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年8月4日,MAGEA4靶点共有在研药物23个,包含的适应症有37种,在研机构26家,涉及相关的临床试验21件,专利多达1249件……Afami-cel是首款实体瘤的工程化T细胞疗法,也是首款TCR-T疗法,具有重要的里程碑意义,也是十多年来治疗滑膜肉瘤的首个有效疗法。期待其后续商业化成功。