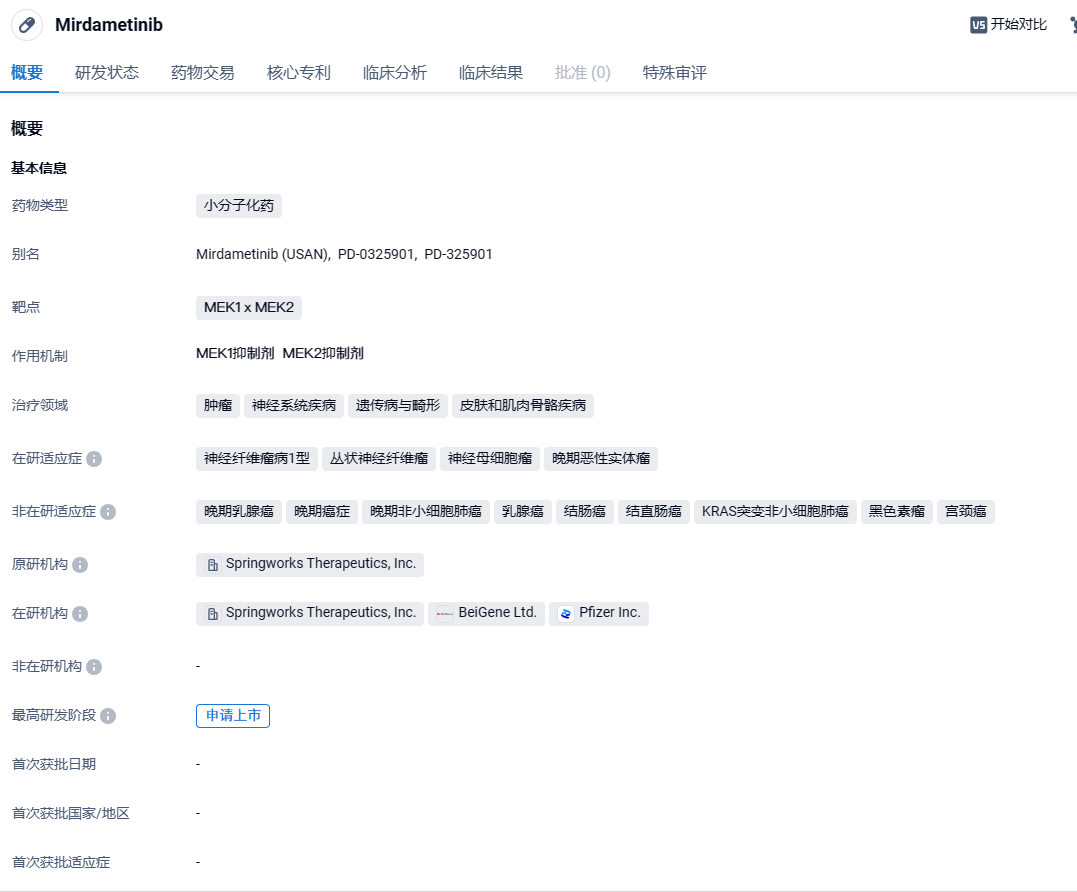
SpringWorks变构小分子MEK抑制剂mirdametinib NDA申请获FDA优先审评资格
8月28日,SpringWorks Therapeutics宣布,美国FDA已接受该公司在研MEK抑制剂mirdametinib的新药申请(NDA),用于治疗神经纤维瘤病1型相关的丛状神经纤维瘤(NF1-PN)的成人和儿童患者,FDA同时授予该申请优先审评资格。该申请的PDUFA目标日期为2025年2月28日。此外,欧洲药品管理局(EMA)也已完成mirdametinib上市许可申请(MAA)的验证。
mirdametinib是SpringWorks继承自辉瑞的一种口服的MEK1 x MEK2小分子抑制剂,原代号为PD-0325901,用于治疗Ⅰ型神经纤维瘤。Mirdametinib在2018年11获得FDA的孤儿药认定并进入快速通道,在2019年7月又获得了欧盟委员会的孤儿药资格。此外,FDA还授予了该药物快速通道资格,用于治疗2岁及以上的NF1-PN患者。Mirdametinib于2019年7月开始了一项为期三年的Ⅱ期临床试验。2024年3月5日,SpringWorks Therapeutics宣布,该公司已开始向美国FDA滚动递交其在研MEK抑制剂mirdametinib的新药申请(NDA),用于治疗儿童和成人神经纤维瘤病1型相关的丛状神经纤维瘤(NF1-PN)。
该新药申请(NDA)主要包含了2b期ReNeu试验的数据。该试验的主要终点是确认客观缓解率(ORR),即通过核磁共振成像(MRI)测量并由盲法独立中央审评(BICR)确认的目标肿瘤体积缩减≥20%。截至2023年9月20日数据截止日,BICR确认的儿童患者客观缓解率为52%,成人患者为41%。Mirdametinib治疗显示出深入而持久的缓解,并在患者报告的关键次要终点指标方面显示出显著改善。根据多个患者报告的结果,ReNeu试验中的儿童和成人患者的疼痛、生活质量和身体功能较基线有统计学上的显著改善。Mirdametinib在试验中总体耐受性良好,大多数不良事件(AE)为1级或2级。
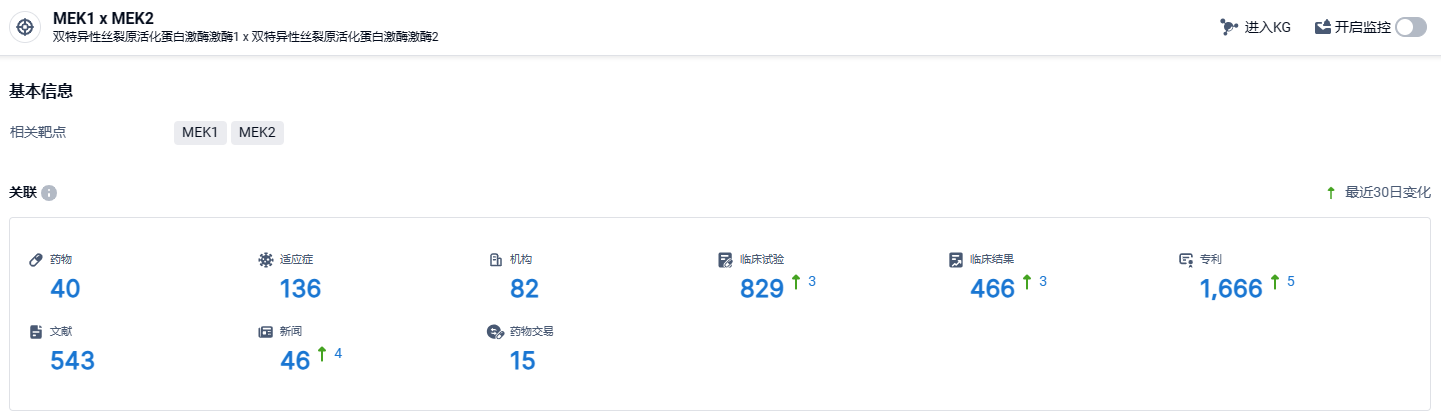
根据智慧芽新药情报库所披露的信息 (点击下方图片直达MEK1 x MEK2靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年8月30日,MEK1 x MEK2靶点共有在研药物40个,包含的适应症有136种,在研机构82家,涉及相关的临床试验829件,专利多达1666件……目前,全球已批准上市四款MEK1/2抑制剂,分别为曲美替尼(Trametinib,Japan Tobacco/诺华);比尼替尼(Binimetinib,辉瑞/Array biopharma);考比替尼(Cobimetinib,罗氏/Exelixis);司美替尼(Selumetinib、阿斯利康/默沙东)。期待Mirdametinib能够早日获批,在MEK靶点赛道脱颖而出。