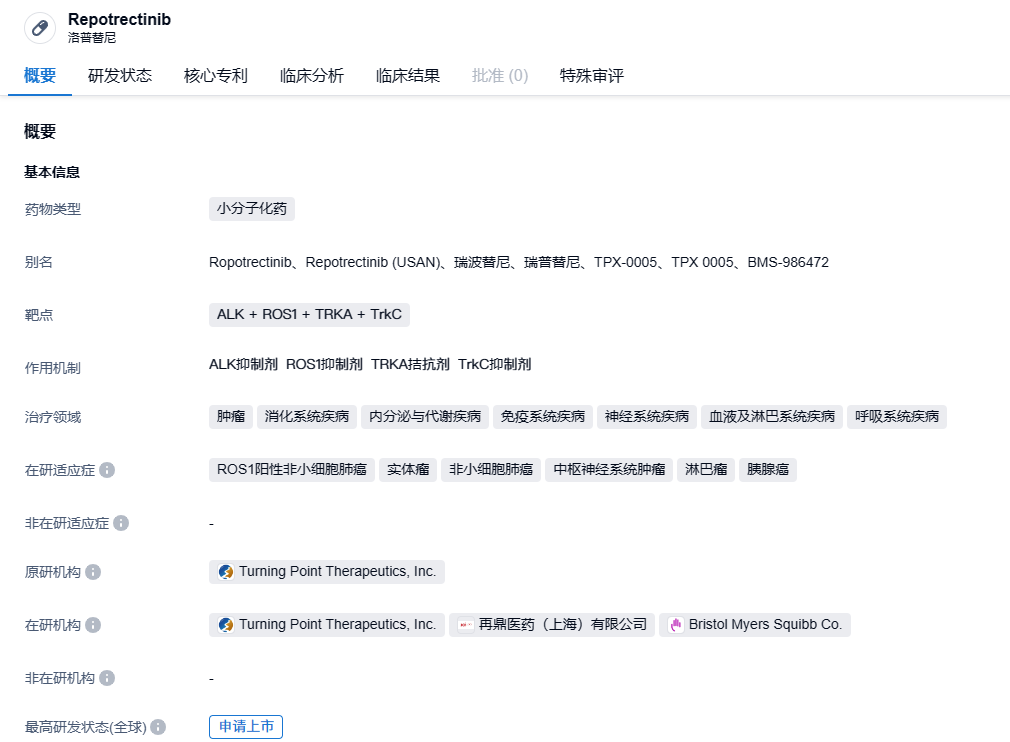
再鼎医药超1.7亿美元引进的创新疗法瑞普替尼拟纳入突破性治疗品种
2023年8月22日,中国国家药监局药品审评中心(CDE)官网公示,再鼎医药递交的repotrectinib(瑞普替尼)胶囊拟被纳入突破性治疗品种,针对的适应症是:治疗既往接受过TRK TKI治疗失败的NTRK融合阳性的晚期实体瘤。
瑞普替尼(TPX-0005)是Turning Point公司开发的一款ROS1和NTRK靶向抑制剂。它具有独特的结构,与靶点蛋白的结合位点位于“ATP口袋”内,并且不受多种耐药性突变的影响。因此,它能够克服多种对其它TKI产生抗性的基因突变,杀死携带ROS1或NTRK基因融合的多种肿瘤细胞,有潜力治疗ROS1阳性的NSCLC,以及ROS1、NTRK和ALK阳性的实体瘤。2020年7月,再鼎医药宣布与Turning Point公司达成合作,获得瑞普替尼在大中华区(包括中国大陆、香港、澳门和台湾地区)的独家开发及商业化权。根据协议条款,Turning Point公司将获得2500万美元的现金预付款,最高至1.51亿美元的潜在里程碑付款等。2022年6月,百时美施贵宝公司宣布与Turning Point公司达成协议,将斥资超过40亿美元收购后者,从而将瑞普替尼纳入其研发管线。此前瑞普替尼已在中国递交针对非小细胞肺癌的新药上市申请,并有三项申请已被CDE纳入突破性治疗品种。
2023年8月16日, 百时美施贵宝公布了TRIDENT-1注册性研究的最新结果,该研究证明新一代TKI瑞普替尼在ROS1阳性的局部晚期或转移性非小细胞肺(NSCLC)癌患者中继续表现出高应答率和持久应答,中位无进展生存期(PFS)达35.7个月。该研究的更新结果将在2023年世界肺癌大会(WCLC)上以口头报告的形式发表。
TRIDENT-1研究是一项评估瑞普替尼治疗ROS1阳性晚期非小细胞肺癌的全球1/2期注册性研究。根据该研究结果,美国FDA受理了瑞普替尼治疗ROS1阳性的局部晚期或转移性非小细胞肺癌成人患者的新药上市申请,并授予其优先审评资格。在此次更新的分析中,瑞普替尼继续证明对TKI初治患者和既往接受过一种TKI且未接受过化疗的患者在内的ROS1阳性NSCLC患者具有持久疗效,包括颅内活性。在中位随访时间为24个月的TKI初治患者(n=71)中,基于独立盲法中心评估(BICR)确认的客观缓解率(cORR)为79%,中位缓解持续时间(DOR)为34.1个月,中位PFS为35.7个月。在基线时可测量脑转移的患者(n=9)中,基于BICR的颅内ORR为89%,且缓解时间延长。
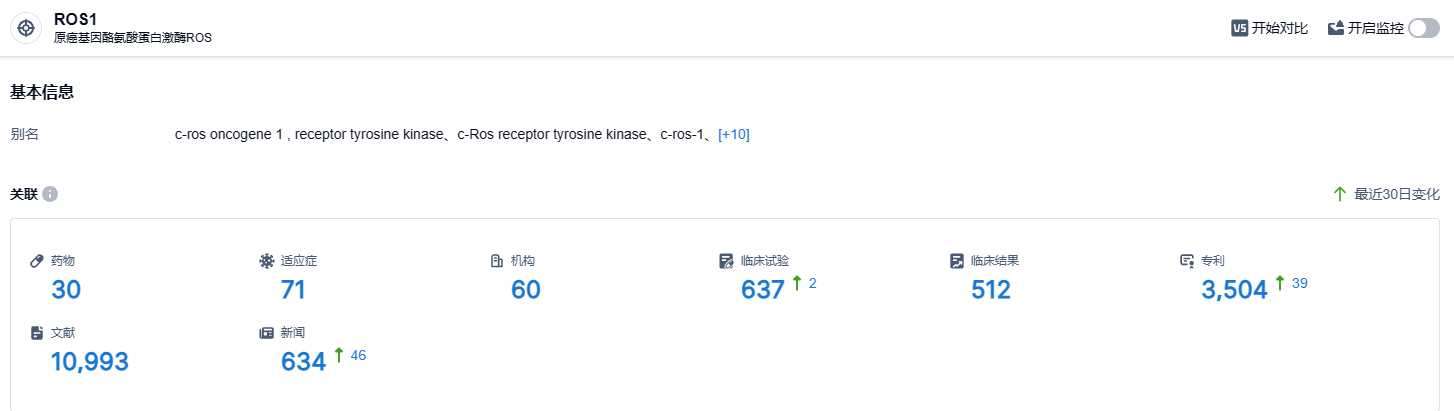
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 ROS1 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年8月23日,ROS1 靶点共有在研药物30个,包含的适应症有71种,在研机构60家,涉及相关的临床试验637件,专利多达3504件……2023年6月28日,中国NMPA受理瑞普替尼的新药上市申请,用于治疗ROS1阳性的局部晚期或转移性非小细胞肺癌成人患者。期待该药能够顺利上市,为肺癌患者带来新的治疗选择。