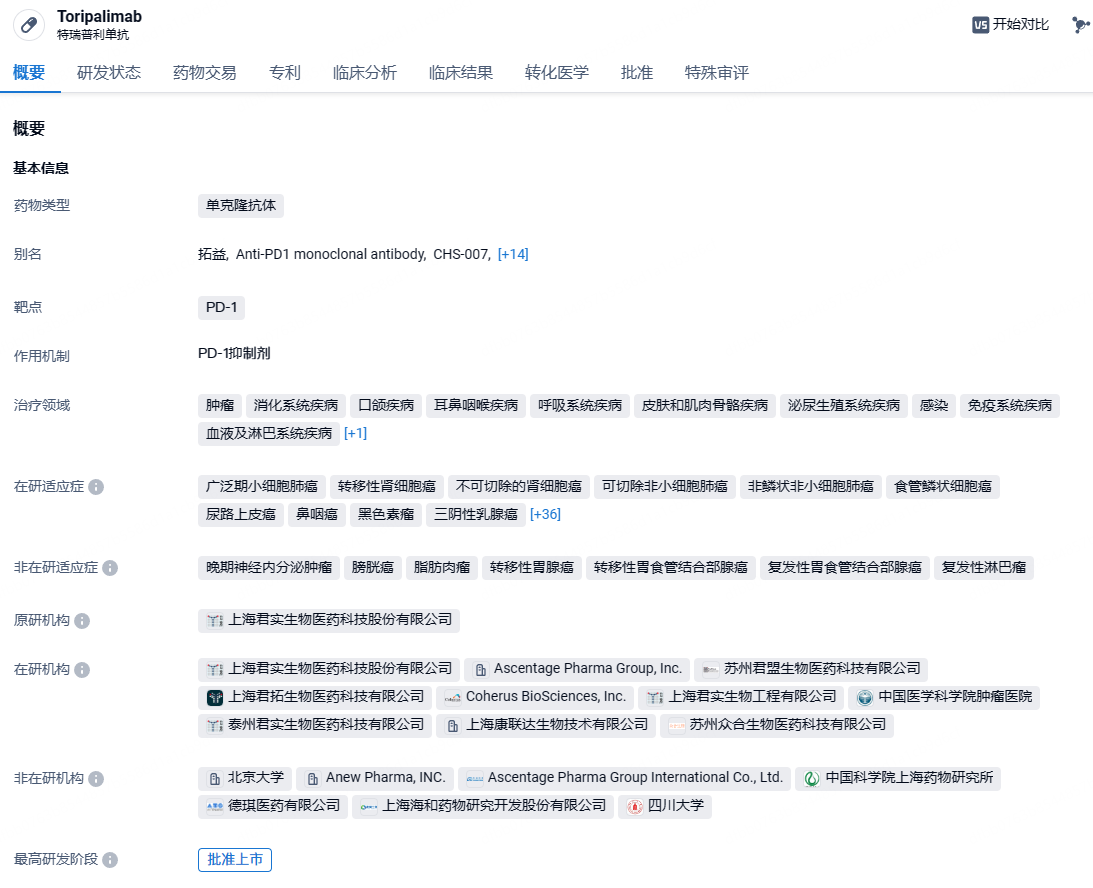
君实生物抗PD-1单抗特瑞普利单抗新适应症获批,用于小细胞肺癌一线治疗!
2024年6月12日,中国国家药监局(NMPA)官网最新公示,君实生物抗PD-1单抗药物特瑞普利单抗的一项新适应症申请已获得批准上市。该药本次获批的适应症为:联合依托泊苷和铂类用于广泛期小细胞肺癌一线治疗。
特瑞普利单抗是我国批准上市的首个国产以PD-1为靶点的单抗药物,由本土创新药企君实生物独立研发,用于多种恶性肿瘤治疗。至今已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖超过15个适应症的40多项由君实生物发起的临床研究。截至目前,特瑞普利单抗已在中国内地获批8项适应症,涵盖黑色素瘤、鼻咽癌、尿路上皮癌、食管鳞癌、非小细胞肺癌、肾癌等,并在美国获批鼻咽癌适应症。此外,该产品用于PD-L1阳性的初治转移或复发转移性三阴性乳腺癌的新适应症上市申请也正在审评中。在国际化布局方面,特瑞普利单抗已在黏膜黑色素瘤、鼻咽癌、软组织肉瘤、食管癌、小细胞肺癌领域获得美国食品药品监督管理局(FDA)授予2项突破性疗法认定、1项快速通道认定、1项优先审评认定和5项孤儿药资格认定。2023年10月,君实生物与Coherus BioSciences共同宣布,特瑞普利单抗(商品名LOQTORZI)在美国获FDA批准上市,成为FDA批准的首个也是目前唯一一个用于鼻咽癌的PD-1单抗。
一项名为EXTENTORCH的随机、双盲、安慰剂对照、多中心的3期临床研究已经评估了特瑞普利单抗或安慰剂联合依托泊苷及铂类在一线治疗ES-SCLC的有效性和安全性。在2023年欧洲肿瘤内科学会(ESMO)大会上,EXTENTORCH研究以大会最新突破摘要(LBA)形式亮相迷你口头报告专场。研究结果显示,相较单纯化疗,特瑞普利单抗联合化疗一线治疗并使用特瑞普利单抗维持治疗的ES-SCLC患者,无进展生存期(PFS)和总生存期(OS)均显著延长、且安全性良好,有望成为ES-SCLC的一线标准疗法。
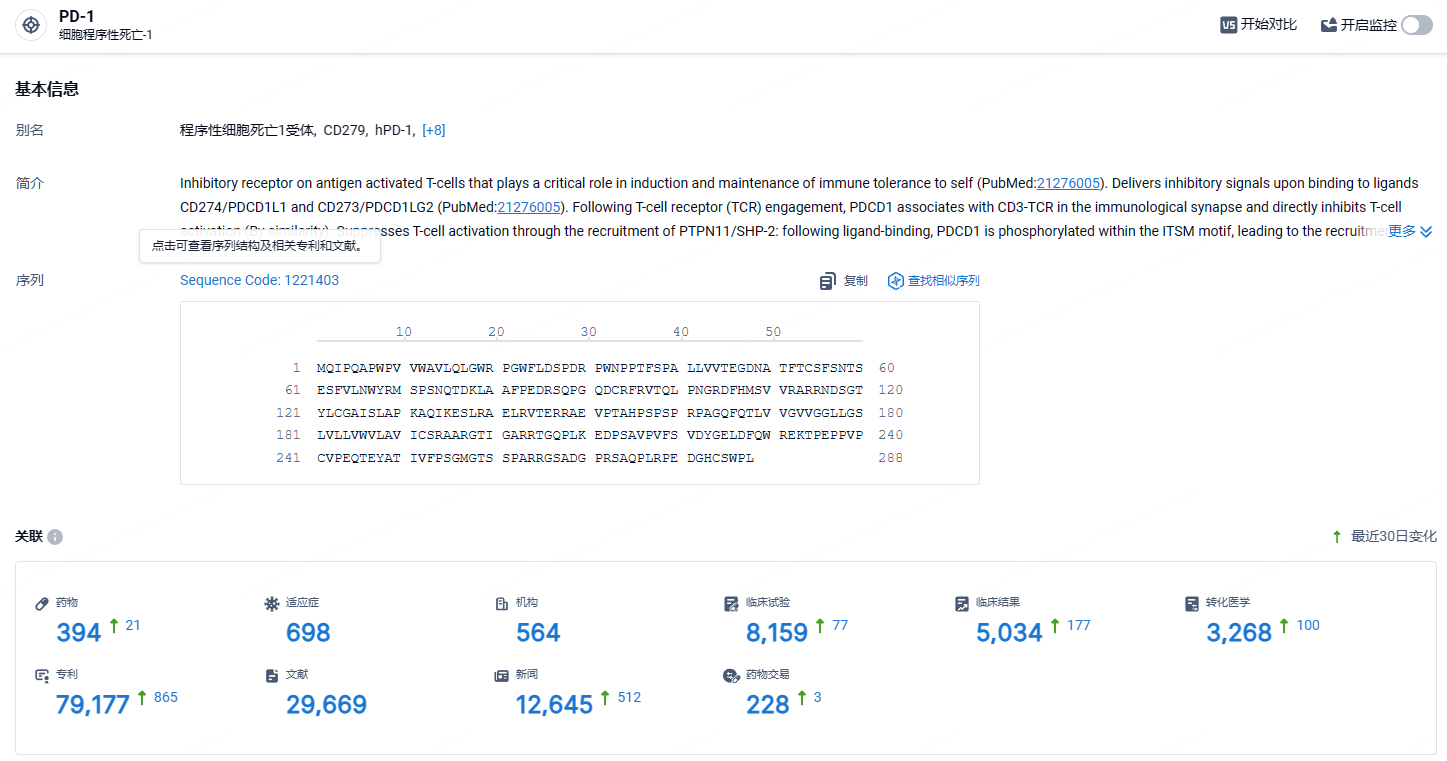
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PD-1 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年6月13日,PD-1 靶点共有在研药物394个,包含的适应症有698种,在研机构564家,涉及相关的临床试验8159件,专利多达79177件……PD-1靶点是研发非常火热的领域,君实的特瑞普利单抗是国产新药的明星产品,期待该药的后续表现。