药明巨诺CAR-T产品瑞基奥仑赛注射液第三项上市申请获受理,治疗套细胞淋巴瘤
2024年1月4日,药明巨诺宣布,中国国家药监局药品审评中心(CDE)已受理其靶向CD19的自体嵌合抗原受体T(CAR-T)细胞免疫治疗产品瑞基奥仑赛注射液新适应症上市许可申请(sBLA),用于治疗复发或难治套细胞淋巴瘤(r/r MCL)患者。这是药明巨诺针对瑞基奥仑赛注射液递交的第三项上市许可申请。
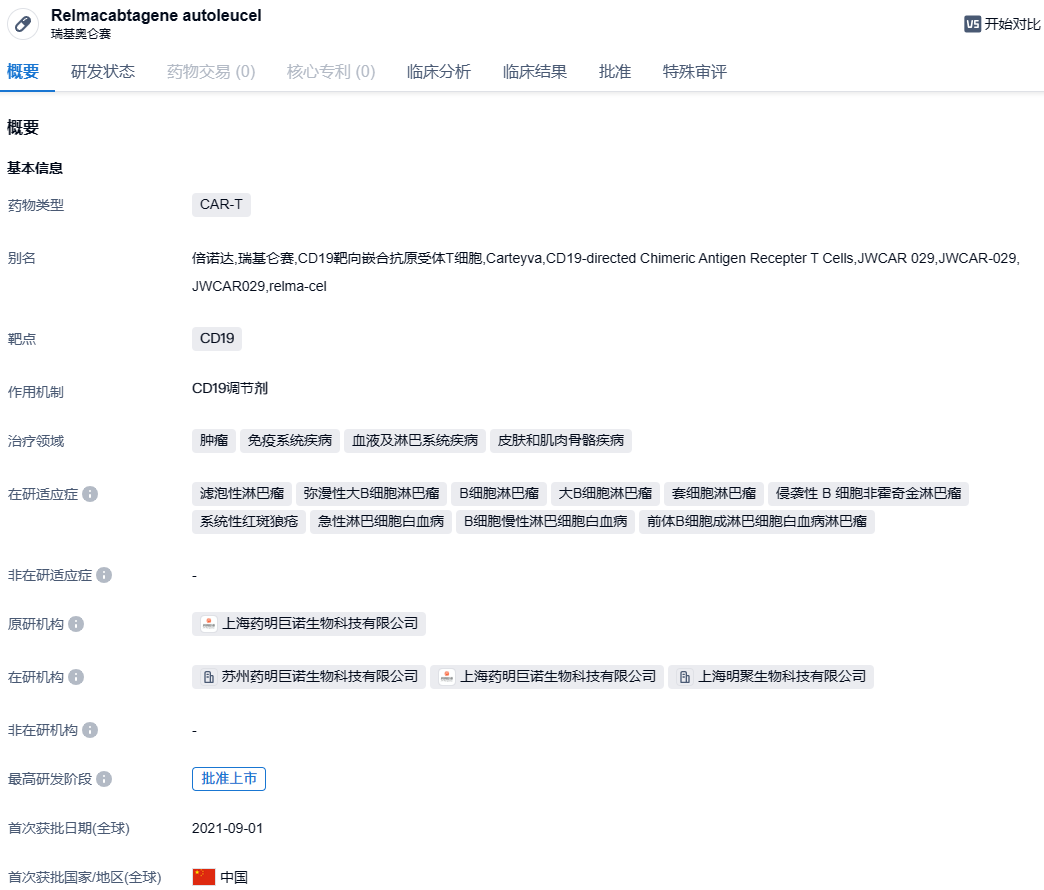
瑞基奥仑赛注射液(relma-cel,JWCAR029)是药明巨诺开发的一种靶向CD19的自体CAR-T治疗产品,于2021年9月1日在我国获批上市,用于治疗经过二线或以上系统性治疗后复发或难治大B细胞淋巴瘤成年患者以及滤泡性淋巴瘤患者。作为药明巨诺的首款产品,瑞基奥仑赛注射液已被中国国家药品监督管理局(NMPA)批准两项适应症,包括治疗经过二线或以上系统性治疗后成人患者的复发或难治性大B细胞淋巴瘤(r/r LBCL),以及治疗经过二线或以上系统性治疗的成人难治性或24个月内复发的滤泡性淋巴瘤(r/r FL)。2023年11月28日,中国国家药监局药品审评中心(CDE)官网公示,药明巨诺CAR-T产品瑞基奥仑赛注射液一项新适应症拟纳入优先审评,拟用于治疗成人复发或难治性套细胞淋巴瘤。
2022年12月,药明巨诺已在第64届美国血液学会(ASH)年会上公布了瑞基奥仑赛注射液针对r/r MCL的2期临床数据。这项单臂开放研究旨在中国成人r/r MCL患者中评估瑞基奥仑赛的初步安全性和有效性。该研究纳入了接受了至少2线治疗(靶向CD20抗体、蒽环类或苯达莫司汀、BTK抑制剂)的MCL患者。患者在清淋化疗后接受了100×106 CAR-T细胞。截至2021年11月30日,11例患者的初步数据显示,瑞基奥仑赛在r/r MCL高危患者中的临床疗效良好,最佳客观缓解率(ORR)为81.8%,最佳完全缓解率(CRR)为54.5%;安全性方面,≥3级的细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)的发生率较低。
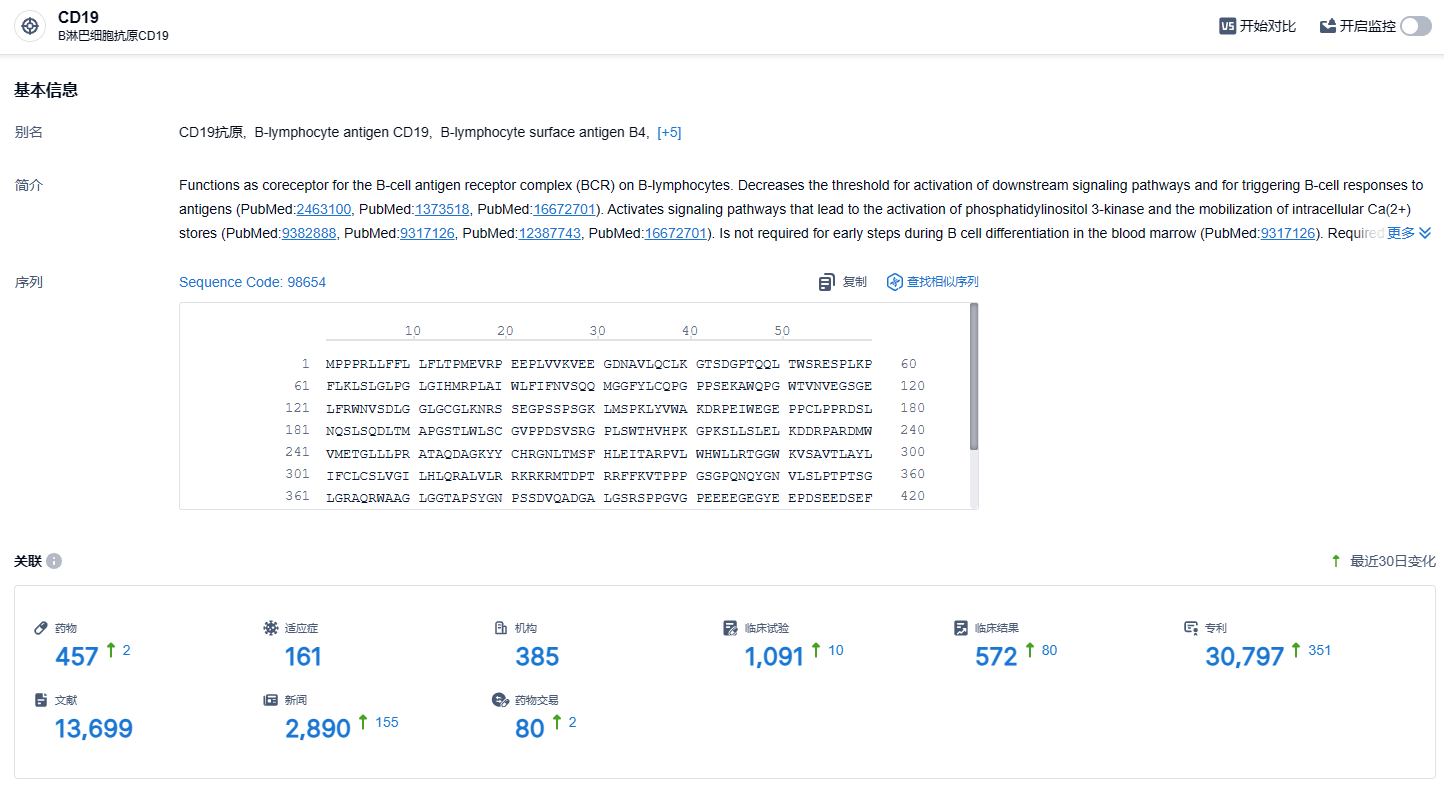
根据智慧芽新药情报库所披露的信息 (点击下方图片直达CD19靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年1月6日,CD19靶点共有在研药物457个,包含的适应症有161种,在研机构385家,涉及相关的临床试验1091件,专利多达30797件……瑞基奥仑赛注射液是首个使用中国生产、符合临床试验生产标准的CAR-T产品,并完全在中国患者中开展的多中心CAR-T研究项目,也根据国内人群特点做了相应的计量调整,想信未来随着技术的发展,可及性的提高,会有越来越多的患者从瑞基奥仑赛的治疗中获益。