强生CD38抗体达雷妥尤单抗(皮下注射)四联疗法获 FDA 批准,治疗多发性骨髓瘤
7 月 30 日,强生宣布,美国 FDA 批准 DARZALEX FASPRO®(达雷妥尤单抗和透明质酸酶-fihj)与硼替佐米、来那度胺和地塞米松 (D-VRd) 联合用于新诊断的多发性骨髓瘤 (NDMM) 患者的诱导和巩固治疗,这些患者适合接受自体干细胞移植 (ASCT)。患者将有机会在初次诊断时接受这种基于 DARZALEX FASPRO® 的四联疗法,为他们提供一种可能显著改善结果的新疗法。
达雷妥尤单抗(daratumumab)是全球首个获批的靶向作用于CD38的全人源单克隆抗体。研究显示,达雷妥尤单抗能够以高亲和力的方式,特异性识别在多发性骨髓瘤恶性浆细胞上高表达的CD38,进而通过多种免疫介导机制来诱导肿瘤细胞的死亡。此前,达雷妥尤单抗已在中国获批用于治疗多发性骨髓瘤患者。DARZALEX FASPRO®属于达雷妥尤单抗皮下注射制剂,是由达雷妥尤单抗和重组人透明质酸酶PH20(rHuPH20)组成的固定剂量复方,仅需3-5分钟即可完成,给药时间大大缩短,提高了治疗便利性。DARZALEX FASPRO®于 2020 年 5 月获得美国 FDA 批准,获批用于治疗九种多发性骨髓瘤适应症,其中四种用于适合或不适合移植的新诊断患者的一线治疗。它是唯一获批用于治疗多发性骨髓瘤患者的皮下CD38靶向抗体。DARZALEX FASPRO®获得FDA批准治疗多发性骨髓瘤以外,它还获得批准治疗免疫球蛋白轻链淀粉样变性。
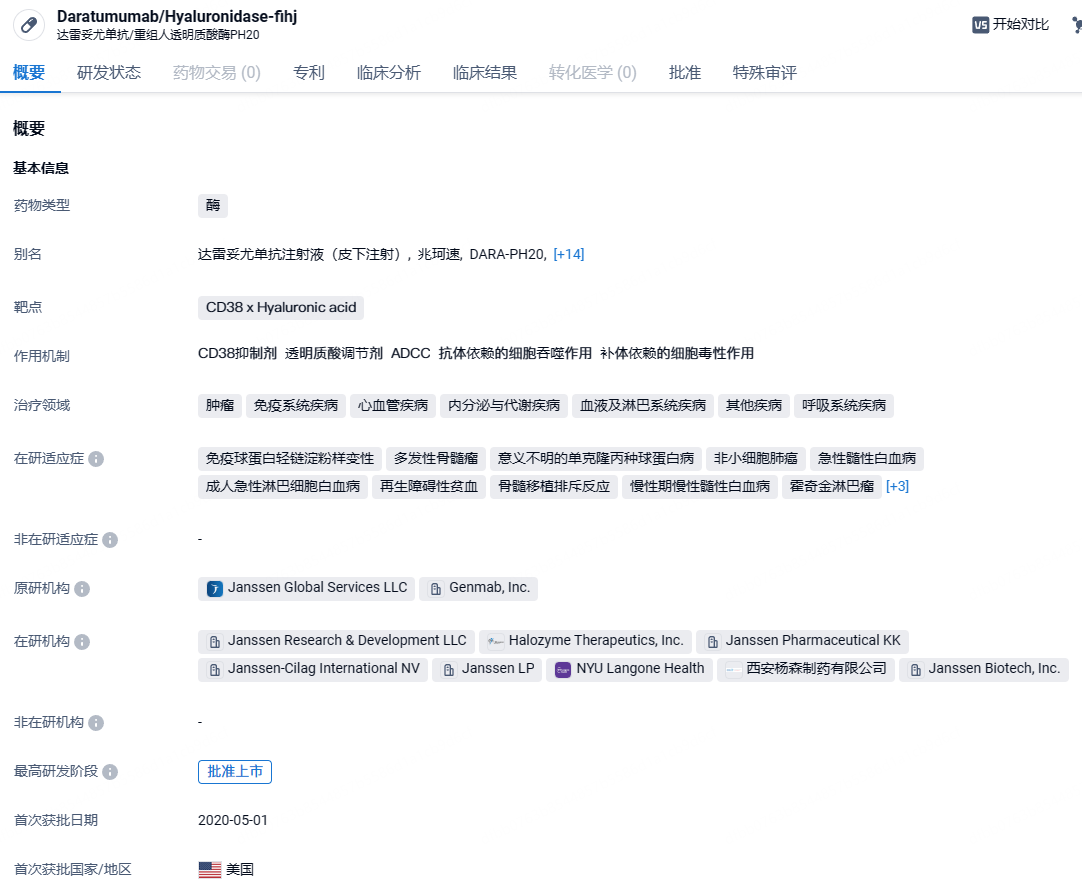
本次的新适应症批准得到了 Ⅲ 期 PERSEUS 研究数据的支持,该研究评估了 DARZALEX FASPRO® 在包括 D-VRd 诱导和巩固治疗的方案中的效果,并与适合 ASCT 的 NDMM 患者在诱导和巩固期间使用硼替佐米、来那度胺和地塞米松 (VRd) 进行了比较。巩固治疗后,患者接受了一项研究性维持治疗方案,包括 DARZALEX FASPRO 与来那度胺联合使用或单独使用来那度胺。PERSEUS 研究结果显示,主要终点无进展生存期 (PFS) 显著改善。与 VRd 相比,D-VRd 将疾病进展或死亡风险降低了 60%。与 VRd 相比,使用 D-VRd 诱导和巩固治疗在巩固期结束时可产生更深的反应:微小残留病 (MRD) 阴性率为 57.5% vs. 32.5%,完全缓解 (CR) 或更好的患者的 MRD 阴性率为 76.6% vs. 58.5%。
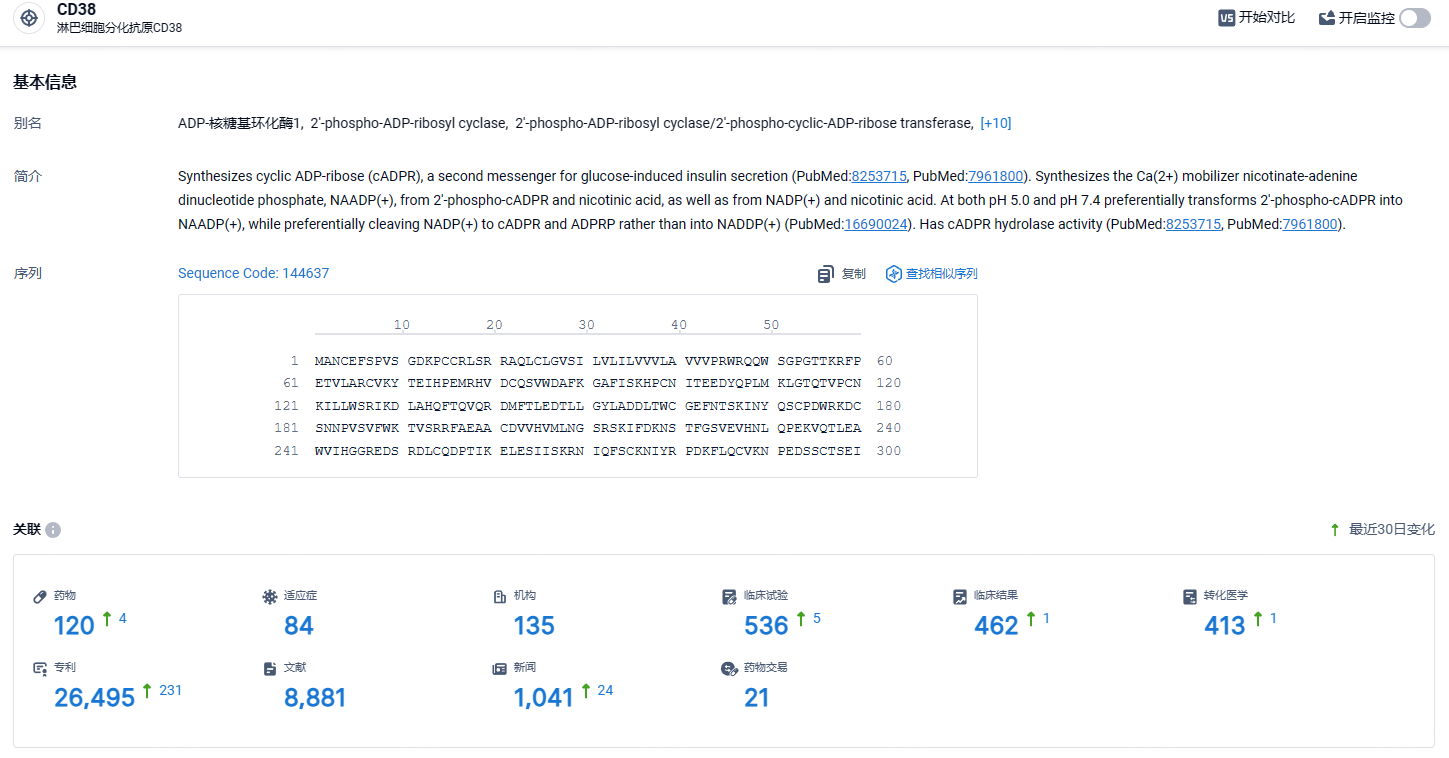
根据智慧芽新药情报库所披露的信息 (点击下方图片直达CD38靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年8月1日,CD38靶点共有在研药物120个,包含的适应症有84种,在研机构135家,涉及相关的临床试验536件,专利多达26495件……达雷妥尤单抗2019年全球销售额为29.98亿美元,2022年全球销售额高达79.77亿美元,同比2021年增长了32.4%。2020年5月,达雷妥尤单抗的皮下注射剂Darzalex Faspro上市,相比Darzalex静脉注射剂可以将给药时间从数小时缩短至3~5分钟。期待达雷妥尤单抗销售额再创新高。