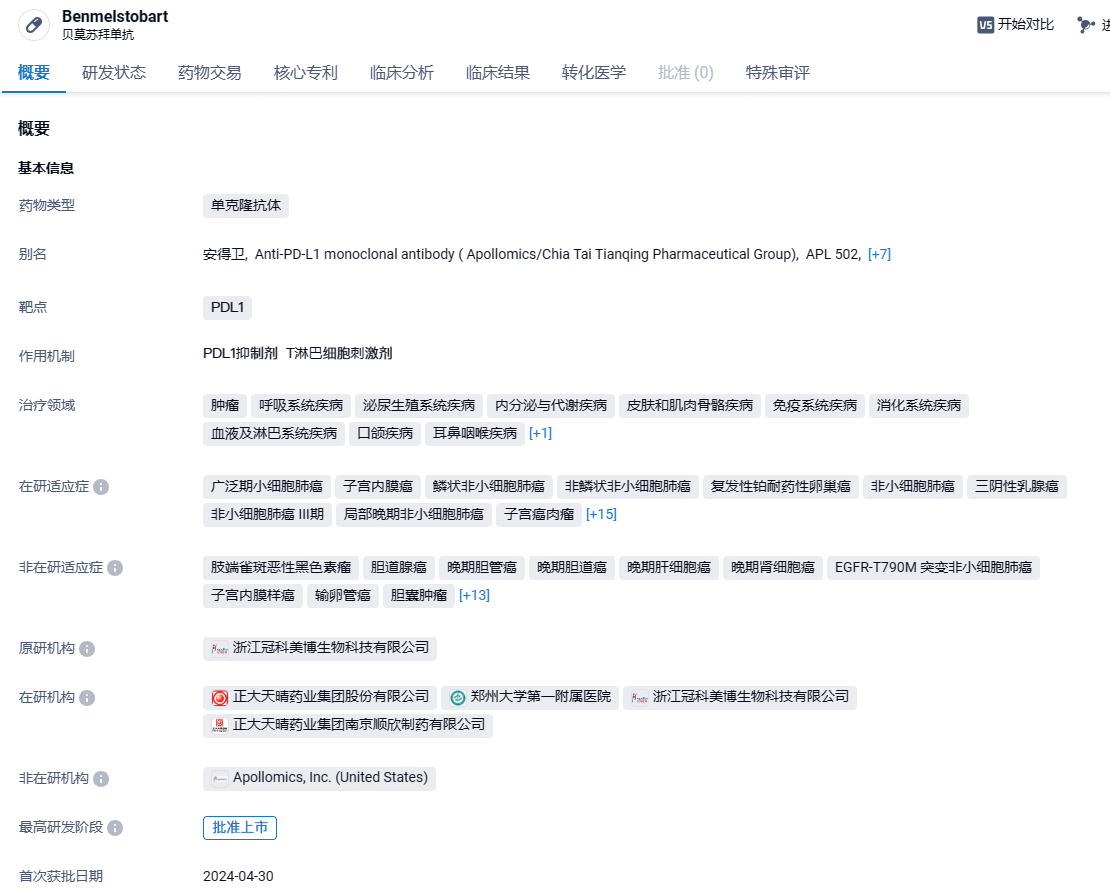
正大天晴PD-L1单抗贝莫苏拜单抗III期结果积极,一线治疗肾细胞癌
2024年5 月 23 日,正大天晴宣布其在研 1 类创新药贝莫苏拜单抗联合安罗替尼用于晚期不可切除或转移性肾细胞癌(RCC)一线治疗的 III 期临床 ETER100 研究主要终点 PFS(基于独立影像评估)达到方案预设的优效界值,且次要终点 OS 显示获益趋势。正大天晴表示将于近期递交该适应症的上市申请。
贝莫苏拜单抗是正大天晴研发的全新序列的创新抗PD-L1人源化单克隆抗体,可阻止PD-L1与T细胞表面的PD-1和B7.1受体结合,使T细胞恢复活性,从而增强免疫应答。贝莫苏拜单抗上市申请已于2023年1月递交国家药品监督管理局并获得受理,目前正在评审中,申报的适应症为联合安罗替尼和依托泊苷及卡铂一线治疗广泛期小细胞肺癌。2024年5月9日,中国生物制药其下属企业正大天晴申报的1类创新药贝莫苏拜单抗注射液(商品名“安得卫” )首个适应症获NMPA批准上市,用于联合盐酸安罗替尼胶囊、卡铂和依托泊苷对广泛期小细胞肺癌(ES-SCLC)患者的一线治疗。这也是盐酸安罗替尼胶囊在中国获批的第6个适应症。
作为国内首个双国产创新药组合用于晚期肾癌免疫治疗关键 III 期研究,ETER100 研究(NCT04523272)是一项随机、开放、阳性药物平行对照、多中心 III 期临床研究,旨在评估贝莫苏拜单抗联合盐酸安罗替尼胶囊对比苹果酸舒尼替尼胶囊一线治疗晚期不可切除或转移性 RCC 的有效性和安全性。结果显示,贝莫苏拜联合安罗替尼一线治疗晚期 RCC 可显著降低患者的疾病进展或死亡风险,同时改善 ORR、OS 等次要终点。贝莫苏拜单抗安全性数据与已知风险相符,未发现新的安全性信号。该研究的详细数据,将在近期国际学术大会上公布。
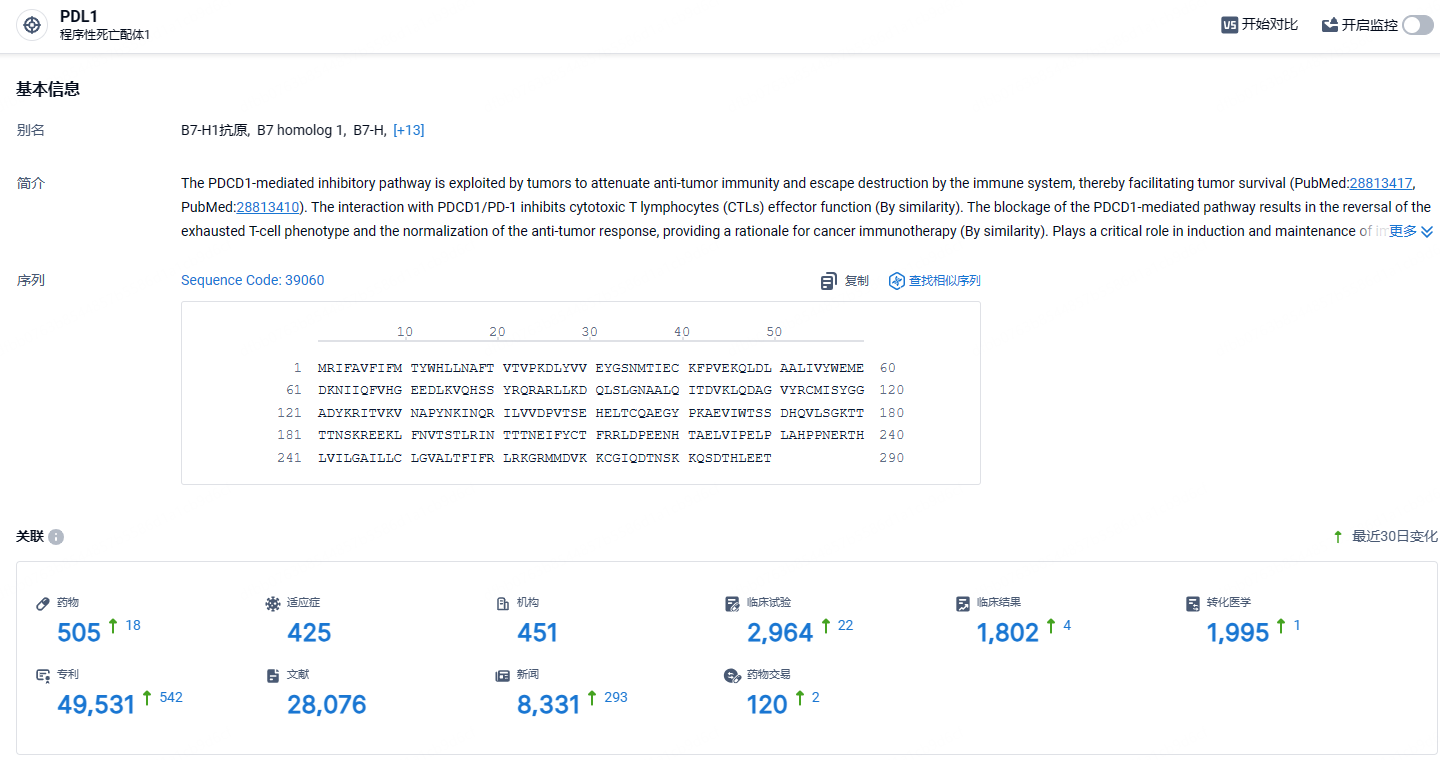
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PD-L1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年5月24日,PD-L1靶点共有在研药物505个,包含的适应症有425种,在研机构451家,涉及相关的临床试验2964件,专利多达49531件……截止目前,国内共有17款PD-(L)1抑制剂获批上市,除去4家海外药企的产品,共有13款国内自研产品上市。国内PD-(L)1抑制剂赛道处于非常内卷的程度,具有更优秀的临床数据和能够解决未满足的医疗需求才是后来企业需要重视的问题。期待贝莫苏拜单抗能够在这场内卷大战中脱颖而出。