预约演示
里程碑!首个渐冻症(ALS)生存改善药物获FDA批准上市
上市批准
近日(2022年9月29日),FDA批准了Amylyx的AMX0035的新药上市申请,用以治疗肌萎缩侧索硬化症(ALS),商品名为Relyvrio。AMX0035的批准成为首个改善ALS功能和生存的新药。
半年的生存获益
ALS是个高度致死疾病,发病机理未知,90%的ALS为偶发性。在Relyvrio之前,被获批使用的Rilutek、Tiglutik、 Mexiletine等均为延缓病情用药,未有任何改善疗法。
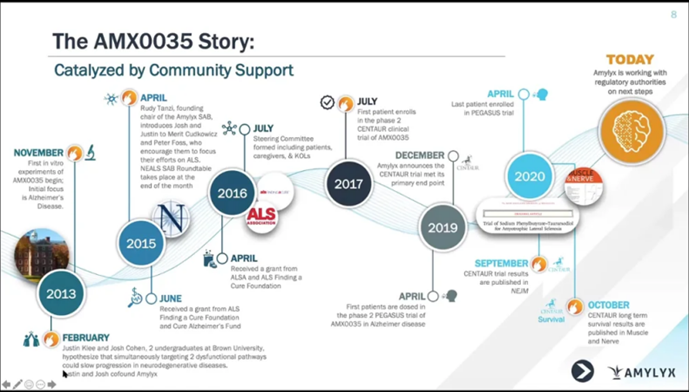
Preview
来源: 佰傲谷BioValley
哈佛医学院的神经病学教授Julieanne Dorn表示:”这是第一个在患者功能和生存期方面都显示出显著临床获益的临床研究“。基于该临床数据,Amylyx已于6月获加拿大批准使用。
上市一波三折
总结
内容来源于网络,如有侵权,请联系删除。
靶点
-药物
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。




