预约演示
更新于:2026-02-21

The Hebrew University of Jerusalem
更新于:2026-02-21
概览
标签
内分泌与代谢疾病
肿瘤
其他疾病
小分子化药
化学药
合成多肽
疾病领域得分
一眼洞穿机构专注的疾病领域
暂无数据
技术平台
公司药物应用最多的技术
暂无数据
靶点
公司最常开发的靶点
暂无数据
| 排名前五的药物类型 | 数量 |
|---|---|
| 小分子化药 | 24 |
| 化学药 | 3 |
| 合成多肽 | 2 |
| 分子胶 | 2 |
| 未知 | 1 |
关联
35
项与 The Hebrew University of Jerusalem 相关的药物靶点 |
作用机制 CaN抑制剂 |
最高研发阶段批准上市 |
首次获批国家/地区 美国 |
首次获批日期1994-04-08 |
靶点 |
作用机制 GR激动剂 |
在研机构 |
非在研适应症 |
最高研发阶段批准上市 |
首次获批国家/地区 日本 |
首次获批日期1988-01-20 |
作用机制 5-HT1A receptor调节剂 [+2] |
非在研适应症- |
最高研发阶段临床1/2期 |
首次获批国家/地区- |
首次获批日期- |
78
项与 The Hebrew University of Jerusalem 相关的临床试验NCT07338695
Evaluation of Hemodynamic Changes in Peripheral Microcirculation in Response to Photobiomodulation Using Non-Invasive Optical and Thermal Technologies
The objective of this study is to assess peripheral microcirculatory hemodynamic responses to photobiomodulation in participants with normal circulation and with functional peripheral vasoconstriction, using noninvasive thermography, photoplethysmography, and laser Doppler flowmetry.
开始日期2026-01-01 |
申办/合作机构 |
NCT06258733
Food Literacy Intervention for Arab and Jewish Women in the Jerusalem Region - is a "Train the Trainer" Approach Feasible and Effective?
Food literacy (FL) is the capability to make healthy food choices in different contexts, settings and situations. Although eating habits are shaped by different circumstances and skills, most nutrition programs focus on nutrition knowledge alone. Addressing factors such as competencies, self-efficacy and social norms enables sustainable positive change in nutrition behaviour. This study will assess a lay leader-led FL workshop to Arab and Jewish women from disadvantaged communities in the Jerusalem region, utilizing a train-the-trainer approach, and will compare the effectiveness and cost-effectiveness of a lay-led FL intervention to an expert-led intervention.
开始日期2025-12-01 |
申办/合作机构 |
ISRCTN14209798
A waitlist-controlled trial evaluating the effects of daily supplementation with 10 g of microgreen powder over 60 days on malnutrition-related symptoms among women of reproductive age in Yangon, Myanmar
开始日期2025-08-20 |
100 项与 The Hebrew University of Jerusalem 相关的临床结果
登录后查看更多信息
0 项与 The Hebrew University of Jerusalem 相关的专利(医药)
登录后查看更多信息
32,875
项与 The Hebrew University of Jerusalem 相关的文献(医药)2026-05-01·MARINE POLLUTION BULLETIN
Large benthic foraminifera as recorders of fine-scale coastal elemental variability
Article
作者: Abramovich, Sigal ; Torfstein, Adi ; Ashckenazi-Polivoda, Sarit ; Yehoshafat, Ofir
Anthropogenic activities and industrial growth significantly impact the marine environment, particularly in coastal areas where human activities intersect with the ocean, often leading to anthropogenic elemental enrichments. Monitoring geochemical signals in seawater, however, is challenging logistically and analytically. As an alternative, calcitic tests of benthic foraminifera provide a nature-based, readily available tool for monitoring environmental signals. This study aimed to demonstrate the applicability of shallow-water large benthic foraminifera as recorders of fine-scale coastal elemental variability, including elements derived from anthropogenic sources. The study focuses on the short coastline of the Gulf of Aqaba-Eilat, which exhibits high diversity in both anthropogenic levels and sources, making it an ideal case study. We report whole-test (ICP-MS) element-to‑calcium ratios in living specimens of the three most common LBF taxa: miliolids (Peneroplis pertusus, soritids) and rotaliids (Amphistegina), collected seasonally from six sites representing urbanized, industrial, and nature reserve areas along the 12-km Israeli coast. Miliolids consistently exhibit elevated El/Ca values and clearer spatial and temporal trends than rotaliids, highlighting their higher sensitivity as environmental recorders. Pb, Zn, and Cd ratios distinguish polluted from relatively clean sites, while Mn enrichment likely reflects freshwater input. Rare-earth elements exhibit a north-to-south enrichment gradient, a distinct seasonal pattern, and a positive gadolinium anomaly, which may reflect anthropogenic inputs from the city of Eilat. Overall, these findings demonstrate that elemental records of miliolid taxa are very effective bioindicators of localized and seasonal geochemical signals in coastal marine environments, offering a practical, nature-based approach to monitoring anthropogenic impacts.
2026-04-01·Current Opinion in Psychology
From inevitable destiny to resilience: A trauma-informed dyadic model of revictimization and relationship resilience
Review
作者: Zamir, Osnat
Revictimization, the tendency of individuals who experienced childhood maltreatment to have violent relationships in adulthood, is well-documented. However, the theory explaining revictimization mechanisms and protective processes remains underdeveloped. This work extends the Couple Adaptation to Traumatic Stress (CATS) model to specify pathways from childhood maltreatment to revictimization and protective processes, integrating advances in three areas: (a) complex trauma, (b) protective processes, and (c) dyadic risk and protective mechanisms. A focused review of recent literature, prioritizing systematic reviews and meta-analyses, offers partial support for the proposed model and underscores the need for continued scholarship on trauma-informed, multilevel dyadic mechanisms for revictimization and protective processes.
2026-03-01·EARLY HUMAN DEVELOPMENT
Corrigendum to “Effectiveness of an oral-motor intervention for premature infants: Feeding and maternal self-efficacy” [Early Human Development 210 (2025) 106382]
作者: Bin-Nun, Alona ; Meroz, Zohar ; Budman, Jennifer R ; Golos, Anat ; Yochman, Aviva
241
项与 The Hebrew University of Jerusalem 相关的新闻(医药)2026-02-19
Dr. Reske has proven leadership in clinical development and regulatory affairs following key role in FDA approval of cartilage repair product Agili-C leading to CartiHeal's $330 million acquisition
HERZLIYA, ISRAEL /
ACCESS Newswire
/ February 19, 2026 /
Regentis Biomaterials Ltd
., ("Regentis" or the "Company") (NYSE American:RGNT), a regenerative medicine company focused on innovative tissue repair solutions, today announced the appointment of Dr. Galit Reske, PhD, as Chief Medical Officer (CMO). Dr. Reske brings extensive experience in clinical development, regulatory strategy, and global clinical operations across the United States, Europe, and Israel, with a particular focus on cartilage repair and osteochondral treatments.
From 2017 to 2026, Dr. Reske served as Director of Clinical Operations at CartiHeal, where she played a central role in the clinical and regulatory advancement of Agili-C
™
, a novel cartilage and osteochondral repair implant. During her tenure, she led the company's IDE Pivotal Study, managing clinical trials across more than 30 sites in the U.S., Europe, and Israel, and oversaw all aspects of clinical operations, clinical regulations, data management, and medical writing.
Dr. Reske was instrumental in securing U.S. FDA approval of Agili-C in 2022, as well as managing regulatory submissions and interactions in the European Union and Israel. Her leadership contributed directly to CartiHeal's successful acquisition by Smith+Nephew in 2023 for
$330 million
.
Prior, she held senior clinical positions including Manager of Clinical Department at TechnoSTAT, where she managed global Phase I-IV clinical studies across multiple therapeutic areas for pharmaceutical and medical device companies. She also served as Medical Product Specialist at Biovo Technologies and Clinical Trials Manager at CRO Consultants. Dr. Reske holds a PhD in Molecular Biology from the Hebrew University of Jerusalem.
"We are very pleased to welcome Dr. Reske to Regentis," said Dr. Ehud Geller, CEO and Executive Chairman of Regentis. "She brings a clear and demonstrated track record of success in cartilage and osteo therapies-from clinical development and pivotal trials through complex regulatory submissions and interactions that have resulted in global approvals, including with the U.S. FDA. Her experience is directly aligned with Regentis' mission as we advance GelrinC®'s clinical and commercial strategy."
"With all her experience, we expect Dr. Reske to play a leadership role in shaping our responsiveness to orthopedic surgeons' needs, our support of planned marketing and sales introductions in Europe, and conference presentations," Dr. Geller added.
Dr. Reske commented, "GelrinC
®
represents a true breakthrough in regenerative medicine. Based on the clinical data generated to date, GelrinC
®
has the potential to significantly improve treatment outcomes for patients with cartilage defects while offering a compelling value proposition for clinicians and healthcare systems. I am excited to join Regentis at this important stage and to help advance GelrinC
®
toward FDA approval, broader clinical adoption, and commercial success."
About GelrinC
®
Regentis' lead product, GelrinC
®
, is a cell-free, off-the-shelf hydrogel synchronized erosion and resorbable implant for the treatment of painful injuries to focal articular knee cartilage. As an innovative regenerative medical product, GelrinC® offers an unprecedented solution that gives surgeons and payers an off-the-shelf, ready to use, simple to perform, reliable, and cost-effective procedure that provides patients with a single, 10-minute procedure, faster recovery, sustained pain relief, and functional improvement for 5 years based on clinical study results to date. No effective off-the-shelf, ready to use treatment for focal knee cartilage defects is currently available on the market. GelrinC
®
has CE Mark approval in the European Union and is now being evaluated in a pivotal U.S. Food and Drug Administration (FDA) study, which has completed over 50% enrollment.
About Regentis Biomaterials
Regentis Biomaterials Ltd is a regenerative medicine company dedicated to developing innovative tissue repair solutions that restore health and enhance quality of life. With an initial focus on orthopedic treatments, Regentis' Gelrin platform technology, based on synchronized, degradable hydrogel implants, regenerates damaged or diseased tissue including inflamed cartilage and bone. Regentis' lead product GelrinC
®
, is a cell-free, off-the-shelf hydrogel that is eroded and resorbed in the knee, allowing the surrounding cells to regenerate the cartilage in a controlled and synchronous process. GelrinC
®
aims to address a market of approximately 470,000 cases for cartilage knee repair annually in the U.S. where no off-the-shelf treatment is available.
Forward Looking Statements
This press release contains "forward-looking statements" that are subject to substantial risks and uncertainties. All statements, other than statements of historical fact, contained in this press release are forward-looking statements. Forward-looking statements contained in this press release may be identified by the use of words such as "anticipate," "believe," "contemplate," "could," "estimate," "expect," "intend," "seek," "may," "might," "plan," "potential," "predict," "project," "target," "aim," "should," "will" "would," or the negative of these words or other similar expressions, although not all forward-looking statements contain these words, and include beliefs regarding Regentis' market positioning. Forward-looking statements are based on Regentis' current expectations and are subject to inherent uncertainties, risks and assumptions that are difficult to predict. Further, certain forward-looking statements are based on assumptions as to future events that may not prove to be accurate. Factors that may affect future results and may cause these forward-looking statements to be inaccurate include, without limitation: the ability of our clinical trials to demonstrate safety and efficacy of GelrinC or any future product candidate, and other positive results; the timing and focus of our preclinical studies and clinical trials, and the reporting of data from those studies and trials; the size of the market opportunity for of GelrinC or any future product candidate, including our estimates of the number of patients who suffer from the diseases we are targeting; our ability to accurately identify demand for product candidates; the success of competing therapies that are or may become available; the beneficial characteristics, safety, efficacy and therapeutic effects of our product candidates; our ability to obtain FDA approval for of GelrinC or any future product candidate and obtain and maintain regulatory approval; our ability to obtain market acceptance of of GelrinC or any future product candidate from the medical community and third-party payors; our plans relating to the further development of GelrinC or any future product candidate, including additional disease states or indications we may pursue; existing regulations and regulatory developments in the United States and other jurisdictions; our plans and ability to obtain or protect intellectual property rights, including extensions of patent terms where available and our ability to avoid infringing the intellectual property rights of others; the need to hire additional personnel and our ability to attract and retain such personnel; our estimates regarding expenses, future revenue, capital requirements and needs for additional financing; our dependence on third parties; our financial performance and our ability to repay our loans and debts; and our ability to negotiate favorable terms in any collaboration, licensing or other arrangements into which we may enter and perform our obligations under such collaborations. For a more detailed description of the risks and uncertainties affecting Regentis, reference is made to the Company's reports filed from time to time with the Securities and Exchange Commission ("SEC"), including, but not limited to, the risks detailed in the section titled "Risk Factors" in the final prospectus related to the public offering filed with the SEC. Forward-looking statements contained in this announcement are made as of this date, and Regentis undertakes no duty to update such information except as required under applicable law.
Contact:
acarlquist@medicavp.com
SOURCE:
Regentis Biomaterials Ltd.
View the original
press release
on ACCESS Newswire
高管变更并购上市批准
2026-02-17
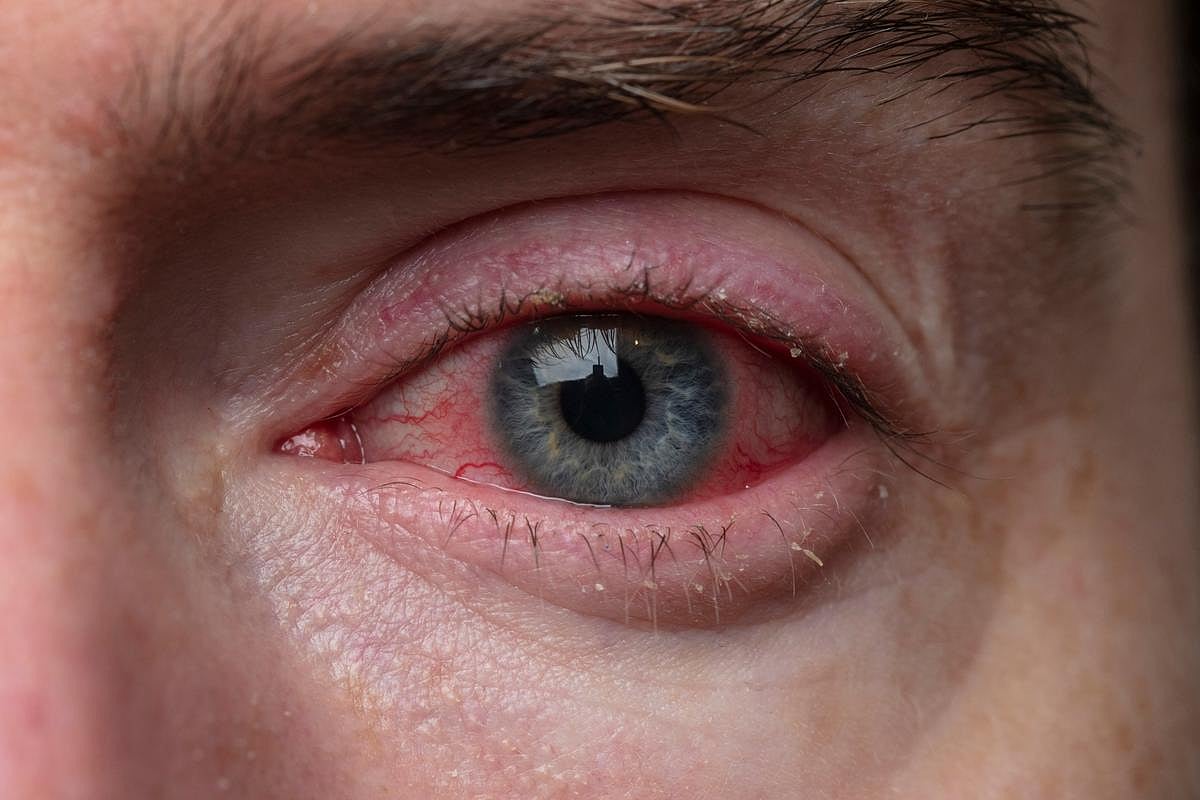
TUESDAY, Feb. 17, 2026 -- For patients aged 5 to 25 years, allergic conjunctivitis is associated with an increased risk for keratoconus and increased corneal diagnostic procedures, according to a study published in the February issue of Contact Lens and Anterior Eye .
Nathan Lishinsky-Fischer, from the Hebrew University of Jerusalem in Israel, and colleagues conducted a retrospective cohort study involving patients aged 5 to 25 years with allergic conjunctivitis and propensity score-matched patients with nonallergic conjunctivitis from the TriNetX U.S. Collaborative Network to examine the risk for keratoconus and related corneal complications.
A total of 174,443 patients were included in each cohort after matching. The researchers found that 118 patients in the allergic conjunctivitis group developed keratoconus compared with 62 in the control group, indicating a significantly increased risk for keratoconus (hazard ratio, 1.6). A significant association was also seen for corneal erosion with allergic conjunctivitis, with a hazard ratio of 1.87. The allergic group more often had corneal topography and advanced corneal diagnostic procedures, with hazard ratios of 1.94 and 2.05, respectively.
"Leveraging a propensity score-matched control group from a multi-institutional electronic health records database, a 60 percent increased risk of keratoconus was observed in patients with allergic conjunctivitis compared to a control group with nonallergic conjunctivitis," the authors write. "These results validate previous clinical observations and strengthen the case for allergic eye disease as a significant risk factor in the pathogenesis of keratoconus."
Abstract/Full Text (subscription or payment may be required)
临床结果
2026-02-16
JERUSALEM, Feb. 16, 2026 /PRNewswire/ -- P-Cure, a supplier of compact, gantry-less proton therapy systems, today announced the first-ever prospective clinical results demonstrating the feasibility, safety, and early efficacy of gantry-less upright proton therapy for lung cancer re-irradiation—an area of critical unmet need in the most common cause of cancer-related mortality worldwide.
Continue Reading
Study at Hadassah Medical Center provides the first prospective clinical evidence of gantry-less upright proton therapy in thoracic re-irradiation.
The P-Cure center is the first and only facility in the world to routinely deliver proton therapy to patients using its upright technology. In partnership with Hadassah Medical Center, the facility has for almost three years pioneered and proven the clinical viability of its compact, gantry-less system.
Lung cancer remains the leading cause of cancer death globally, with millions of new cases diagnosed each year and a growing population of long-term survivors who may later require additional local treatment. As systemic therapies improve survival, the clinical demand for safe and effective thoracic re-irradiation is increasing, yet remains severely constrained by toxicity risks to vital organs.
The study was conducted by Hadassah Medical Center and represents a historic milestone for radiation oncology, providing the first prospective clinical evidence worldwide supporting upright, image-guided proton therapy delivered without a rotating gantry in thoracic re-irradiation.
Thoracic re-irradiation is among the most challenging indications in cancer care due to cumulative radiation exposure to critical organs such as the lungs, heart, esophagus, and spinal cord—a challenge particularly pronounced in lung cancer patients, who often present with compromised baseline pulmonary function. Until now, no prospective clinical data had been published demonstrating the use of gantry-less upright proton therapy in this high-risk patient population.
The interim analysis included ten patients with recurrent thoracic malignancies, the majority diagnosed with non-small cell lung cancer, all of whom had previously received definitive radiotherapy. Patients were treated using upright, image-guided intensity-modulated proton therapy (IMPT) delivered on a compact, gantry-less P-Cure proton therapy system.
All patients completed treatment without interruption. At three months post-treatment, local control within the re-irradiated volume was 100%, with complete metabolic response, partial response, or stable disease observed in all evaluable patients. Acute toxicity was predominantly mild (grade 1–2), with only one reported grade 3 hematologic event. Importantly, patient-reported quality of life remained stable, with no clinically meaningful deterioration—a particularly significant finding in lung cancer, where treatment-related morbidity often limits therapeutic options.
Dosimetric comparisons showed that upright IMPT achieved statistically significant reductions in radiation dose to the lungs, heart, esophagus, and spinal cord compared with state-of-the-art photon VMAT, while maintaining equivalent target coverage. Upright positioning increased total lung volume by an average of 9.8%, reinforcing the anatomical and functional rationale for upright thoracic treatment in lung cancer patients.
These findings confirm that gantry-less upright proton therapy can safely deliver thoracic re-irradiation while improving normal tissue sparing—a key barrier that has historically limited re-irradiation in lung cancer, despite the disease's high prevalence and clinical need.
"Thoracic re-irradiation carries a very narrow therapeutic window, and many lung cancer patients are simply not candidates for further radiation using conventional approaches," said Prof. Aron Popovtzer, Principal Investigator of the study and Director of the Sharett Institute of Oncology at Hadassah. "For the first time ever, we now have prospective clinical evidence showing that gantry-less upright proton therapy can be delivered accurately and safely in this setting."
Dr. Philip Blumenfeld, co-Principal Investigator, lung cancer specialist, and Director of the Advanced Radiotherapy Unit at Hadassah, added: "Given the sheer number of lung cancer patients worldwide, even incremental improvements in safety and tolerability can have an enormous clinical impact. The combination of excellent early tumor control, low acute toxicity, and preserved quality of life is highly encouraging."
All treatments were delivered using the P-Cure Proton Therapy System, which integrates a compact proton synchrotron, fixed horizontal beamline, vertical CT imaging, and a robotic treatment support that can position the patient both seated and supine. By eliminating the need for a rotating gantry, the system enables gantry-less proton therapy with a dramatically reduced footprint, lower infrastructure complexity, and improved economic feasibility.
"Lung cancer represents one of the largest and most urgent opportunities in radiation oncology," said Michael Marash, CEO of P-Cure. "Demonstrating success in this high-volume, high-risk indication underscores the potential of compact proton therapy systems to expand access globally—without compromising clinical outcomes."
Beyond lung cancer, the findings support a broader shift toward scalable, cost-effective proton therapy, enabling healthcare systems worldwide to adopt advanced radiation treatments that were previously limited to large, high-cost facilities.
Longer follow-up and continued patient enrollment are ongoing to evaluate late toxicity and long-term outcomes.
About P-Cure
P-Cure is redefining proton therapy through compact, gantry-less systems designed to expand global access to advanced radiation treatment. By enabling upright and supine, image-guided proton therapy with a significantly reduced facility footprint and infrastructure burden, P-Cure aims to make proton therapy more affordable, scalable, and clinically impactful.
About Hadassah Medical Center
Hadassah Medical Center, affiliated with the Hebrew University of Jerusalem, is an internationally recognized academic medical center and a global leader in clinical care, medical research, and medical education. Renowned for its innovation in oncology and precision medicine, Hadassah plays a central role in pioneering advanced radiotherapy techniques and translating cutting-edge research into clinical practice.
SOURCE P-Cure
21%
more press release views with
Request a Demo
放射疗法临床结果
100 项与 The Hebrew University of Jerusalem 相关的药物交易
登录后查看更多信息
100 项与 The Hebrew University of Jerusalem 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2026年03月01日管线快照
管线布局中药物为当前组织机构及其子机构作为药物机构进行统计,早期临床1期并入临床1期,临床1/2期并入临床2期,临床2/3期并入临床3期
药物发现
4
31
临床前
其他
34
登录后查看更多信息
药物交易
使用我们的药物交易数据加速您的研究。
登录
或

转化医学
使用我们的转化医学数据加速您的研究。
登录
或

营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或

科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或

投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或

融资
发掘融资趋势以验证和推进您的投资机会。
登录
或

生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用





