安进OX40单抗Rocatinlimab在国内启动另一III期临床试验,治疗中重度特应性皮炎
2023年10 月 8 日,据 CDE 官网显示,安进OX40单抗Rocatinlimab(AMG 451)国内启动新 III 期临床 ROCKET-ASCEND 试验(登记号:CTR20233073),这是一项旨在评估 Rocatinlimab 用于中度至重度特应性皮炎(AD)成人和青少年受试者的长期安全性、耐受性和有效性的多中心、双盲维持研究。
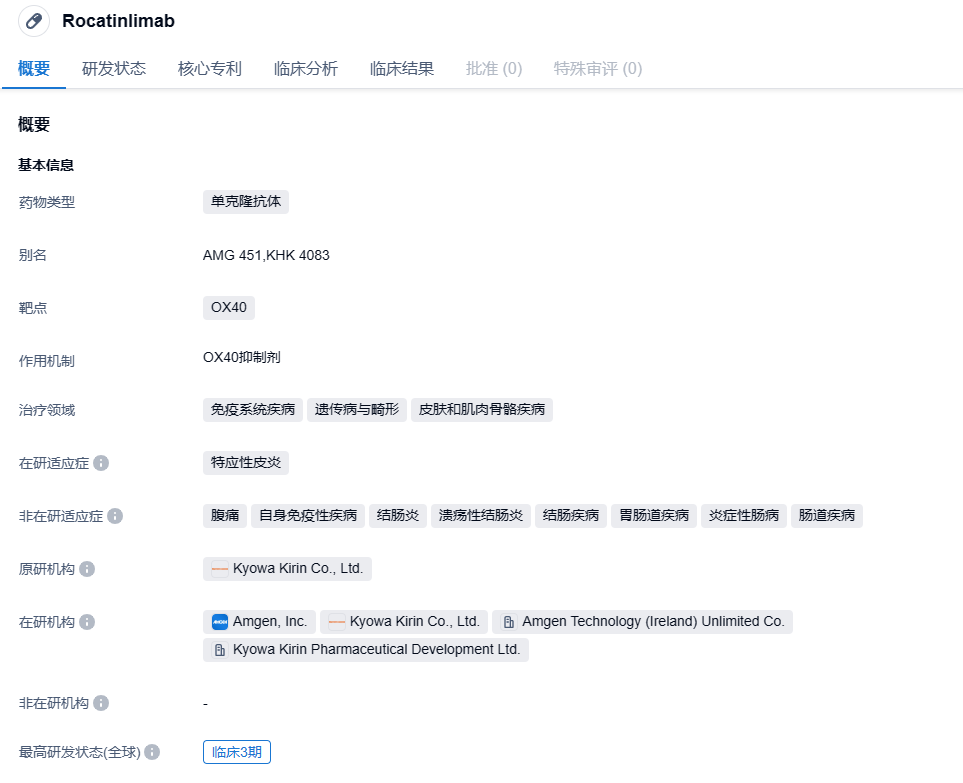
Rocatinlimab(KHK4083)是一种抗OX40单克隆抗体,可抑制和减少表达OX40的活化T细胞的数量。它是一种人类非岩藻糖基化形式的IgG1抗体,可诱导抗体依赖性细胞毒性,从而具有靶向致病细胞的能力。2021 年 6 月,安进以 4 亿美元首付款和 8.5 亿美元的里程碑付款引进 Rocatinlimab。根据协议,安进获得了 Rocatinlimab 在除日本外全球所有市场的开发、生产和商业化权益,协和麒麟保留该产品在日本的所有权利。如若获得批准,两家公司将在美国共同推广 Rocatinlimab,协和麒麟拥有包括欧洲和亚洲在内的某些其他市场共同推广的选择权。
OX40(又称CD134)是一类重要的T细胞共刺激分子,其免疫调节作用一方面是通过调控效应T细胞的增殖和存活从而增强免疫活性,另一方面是抑制调节性T细胞(Tregs)的活性和增殖。刺激免疫反应的OX40激动剂设计目的就是提高T细胞效应,增强免疫应答。OX40的这种生物学特性,意味着基于这一靶点开发的抗体,有望对多种免疫系统疾病带来治疗效果,包括肿瘤、特应性皮炎等。
一项在美国、加拿大、日本和德国的65个二级和三级中心进行的多中心、双盲、安慰剂对照的2b期研究(NCT03703102)评估了抗OX40抗体rocatinlimab在成人中度至重度特应性皮炎中的疗效和安全性。该研究证实与安慰剂相比,接受Rocatinlimab治疗的特应性皮炎患者的疾病严重程度在16周内有较大改善;而且在36周治疗结束前,病情仍在逐渐好转。并且,较其他针对特应性皮炎的治疗手段不同的是,大多数接受Rocatinlimab治疗的患者在停药后依旧能够维持EASI-75至56周。
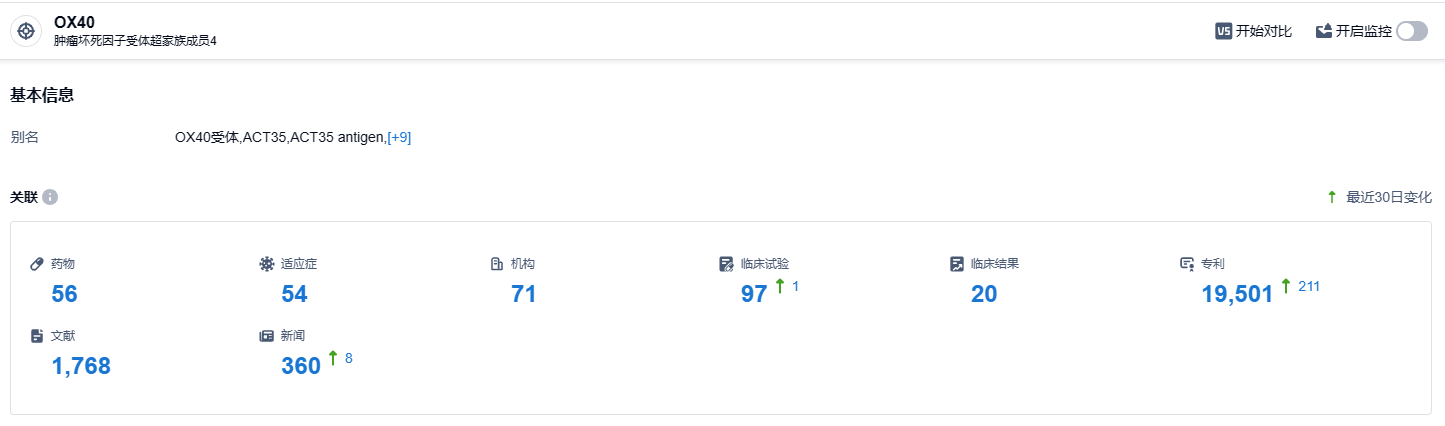
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 OX40 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年10月9日,OX40 靶点共有在研药物56个,包含的适应症有54种,在研机构71家,涉及相关的临床试验97件,专利多达19501件……截至目前,Rocatinlimab 共启动开展多项III期临床试验。而在国内,Rocatinlimab 于 2022 年 12 月首次在国内申报临床,2023年 3 月首次获批临床,目前已经启动两项III期临床试验。期待Rocatinlimab能够早日获批。