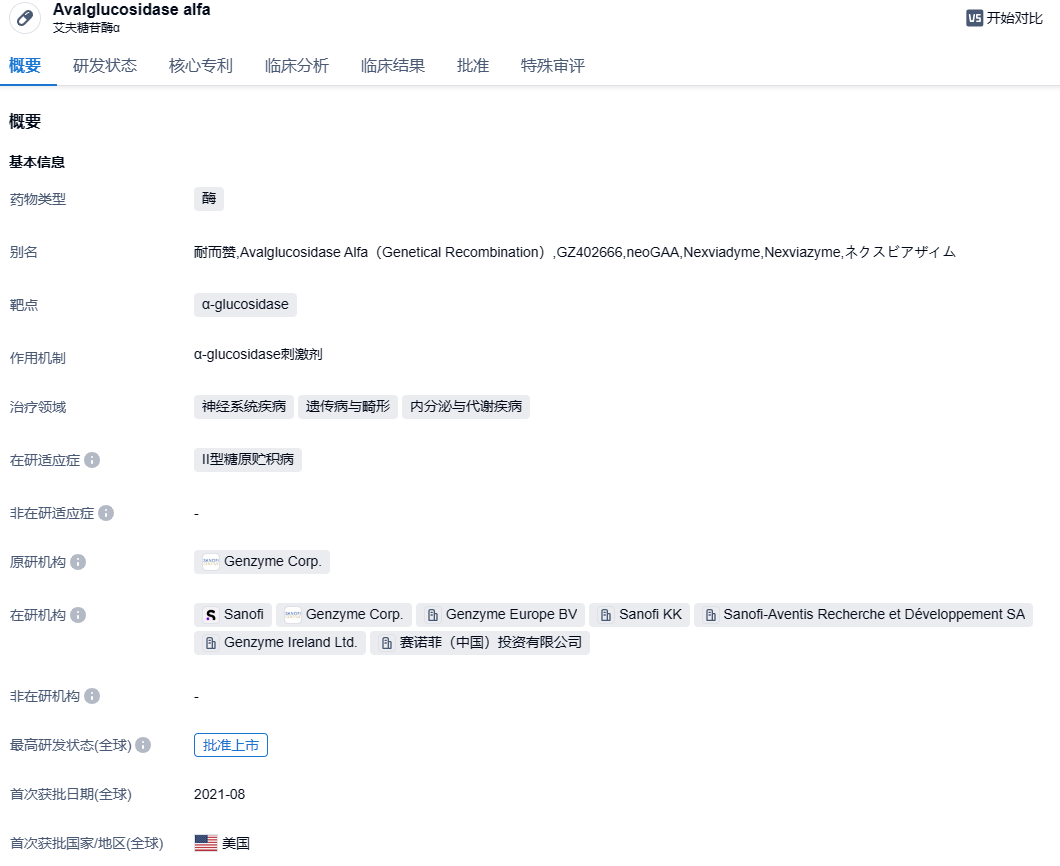
赛诺菲罕见病新药注射用艾夫糖苷酶α在华获批上市,治疗庞贝病
2023年10月7日,赛诺菲宣布其罕见病新药注射用艾夫糖苷酶α(商品名:耐而赞)获国家药监局批准上市,用于庞贝病(酸性α葡萄糖苷酶[GAA]缺乏症)患者的长期酶替代治疗。
艾夫糖苷酶α是第二代酶替代疗法,可以靶向6-磷酸甘露糖(M6P)受体,从而改善GAA向肌肉细胞的递送,使得多余的糖原得以分解,减少对患者肌肉细胞的损伤。2021年8月,该产品获FDA批准上市,用于治疗1岁及以上患者治疗晚发型庞贝氏症;2022年6月在欧洲获批上市。2018年5月,中国国家卫生健康委员会联合五部门发布的《第一批罕见病目录》将庞贝病列入其中。此次艾夫糖苷酶α在国内上市,为该类疾病患者提供了新的治疗选择。
一项随机、双盲、多国、多中心的关键III期COMET研究评估了艾夫糖苷酶α在100例庞贝病患者中的疗效以及安全性。97周的扩展研究结果显示,与基线相比:在初步分析期(49周)和扩展研究期均接受艾夫糖苷酶α治疗的患者,用力肺活量(FVC)预测值百分比提高2.65(1.05)个百分点,6分钟步行试验(6MWT)距离增加18.60(12.01)米;扩展研究期间由第一代酶替代治疗药物转而接受艾夫糖苷酶α治疗的患者,FVC预测值百分比提高0.36(1.12)个百分点,6MWT距离增加4.56(12.44)米。此外,在初步分析期内,艾夫糖苷酶α安全性良好,扩展研究期亦未观察到新的安全性事件。
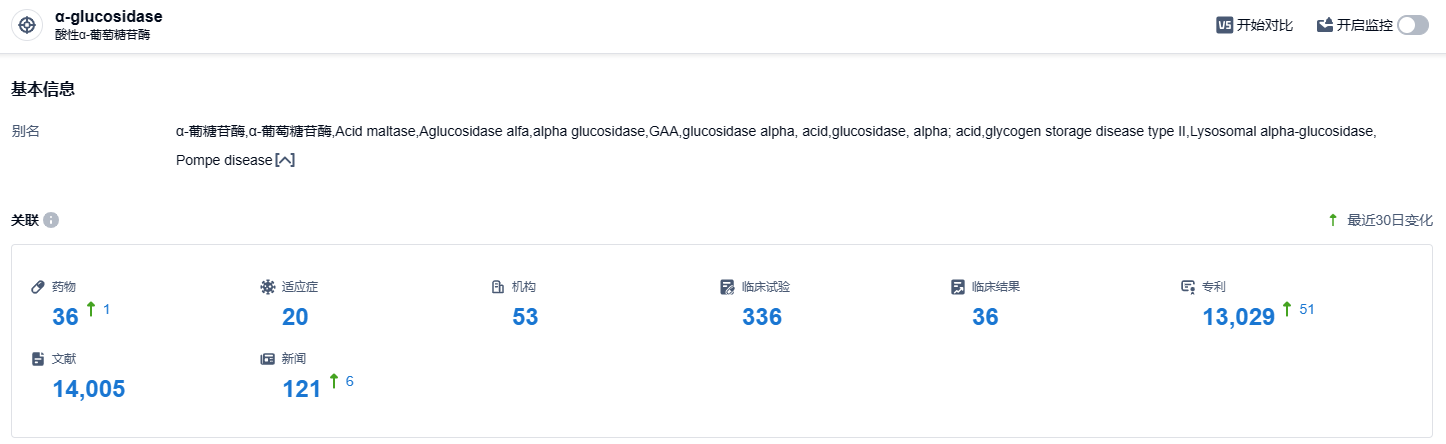
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 GAA 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年10月9日,GAA靶点共有在研药物36个,包含的适应症有20种,在研机构53家,涉及相关的临床试验336件,专利多达13029件……目前艾夫糖苷酶α已在全球多个国家和地区获批,包括美国、欧盟、日本、中国、加拿大、澳大利亚和巴西等,并获得FDA授予突破性疗法认定。同样由赛诺菲开发的用于庞贝病治疗的注射用阿糖苷酶α(商品名:美尔赞)已于2017年在国内获批上市,用量为20mg/kg,需终身用药,目前,部分省市已将美尔赞纳入了医保。期待阿糖苷酶α和艾夫糖苷酶α两款新药能够为国内庞贝病患者带来更加有效的治疗体验。